
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Гистидиндекарбоксилаза
|
|
Этот фермент имеет абсолютную субстратную специфичность - превращает гистидин в гистамин:
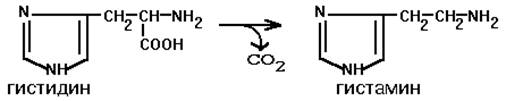
Гистамин является медиатором и содержится в нервных клетках и в тучных клетках. Обладают сильным сосудорасширяющим действием. Гистамин хранится в секреторных гранулах и секретируется в кровь при повреждении ткани (удар, ожог и т.д.). Особенно много его выделяется в очаге воспаления. Гистамин играет важную роль в проявлении аллергических реакций. Известно 2 типа рецепторов к гистамину:H1 и H2.
Эффекты гистамина:
- расширение капилляров и повышение сосудистой проницаемости;
- понижение артериального давления;
- повышение тонуса (спазм) гладких мышц - в том числе гладкой мускулатуры бронхов;
- усиление секреции желудочного сока;
Некоторые из этих эффектов позволяют гистамину принимать участие в формировании аллергических проявлений.
Антигистаминные препараты применяются с целью предотвратить образование гистамина и обладают противовоспалительным и антиаллергическим действием. По механизму действия некоторые из них являются ингибиторами гистидиндекарбоксилазы, а другие конкурируют с гистамином за взаимодействие с рецепторами клеток.
Блокаторы Н1-рецепторов используются в основном как противоаллергические средства - димедрол, супрастин и т.д.
4. Сериндекарбоксилаза. Катализирует первую реакцию синтеза ацетилхолина из серина. Ацетилхолин – возбуждающий медиатор вегетативной нервной системы.
5. Декарбоксилаза ароматических аминокислот
Имеет широкую субстратную специфичность. Превращает несколько разных аминокислот:
а) триптофан - в триптамин
б) 5-окситриптофан - в триптамин (серотонин)
в) 3,4-диоксифенилаланин - в дофамин
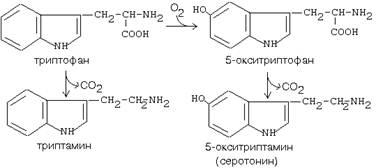
Серотонин вырабатывается в нервной ткани. Некоторые виды головных болей (мигрени) связаны с избыточной выработкой серотонина. Серотонин сужает сосуды, регулирует свертывание крови. Обладает антиаллергическим действием. Триптамин обладает сходным эффектом.
Аминокислота фенилаланин может в результате окисления присоединять две ОН-группы в кольце и превращаться в диоксифенилаланин (ДОФА). Из него под действием декарбоксилазы ароматических аминокислот образуется дофамин. Дофамин является предшественником катехоламинов - норадреналина и адреналина.
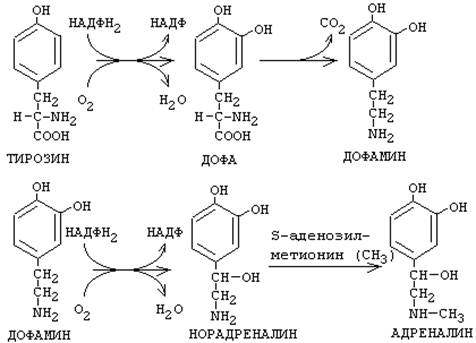
Кроме функции предшественника, ДОФАмин имеет свои специфические функции.
ИНАКТИВАЦИЯ БИОГЕННЫХ АМИНОВ
В организме имеются механизмы, позволяющие разрушать биогенные амины.
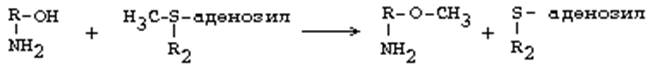
1. Метилирование по оксигруппам тех аминов, которые такие группы содержат, либо включают оксигруппы в свою молекулу после гидроксилирования. Источник метильного радикала: S-Аденозилметионин. Реакцию катализируют ферменты - О-метилтрансферазы. Они переносят метильную группу на кислород. После присоединения аденильного остатка АДФ к сере метионина, метильная группа метионина становится очень мобильной и легко переносится на разные вещества. В том числе и на кислород оксигрупп.
2. Окисление амина по аминогруппе с целью дезаминирования.
Главный путь инактивации биогенных аминов - их окисление под действием оксидаз с отщеплением аминогруппы. В результате исчезает биологическая активность амина.

Оксидазы биогенных аминов: моноаминооксидаза (МАО), диаминооксидаза (ДАО), полиаминооксидаза. Оксидазы отнимают два протона и два электрона и передают их сразу на кислород. Образуется перекись водорода, а амин превращается в ИМИН. Этот имин легко гидролизуется без участия фермента и превращается в альдегид. Простетической группой ферментов оксидаз является ФАД или ФМН, т.е. они являются флавопротеинами.
Вторая реакция (гидролиз) необратима. Образовавшийся в итоге альдегид легко окисляется до карбоновой кислоты, которая распадается до СО2 и H2O. МАО в клетке больше, чем ДАО.
Угнетение МАО приволит к замедлению распада биогенных аминов. Такие лекарства продлевают период существования биогенных аминов, что особенно важно при их недостатке. Эти вещества играют роль антидепрессантов и используются, в частности, при лечении шизофрении.
Аминокислоты декарбоксилируются в цитоплазме, а окисление аминов происходит в наружной мембране митохондрий. Поскольку реакция декарбоксилирования аминокислот и разрушение биогенных аминов происходят не одновременно, то биогенные амины могут некоторое время существовать и выполнять свою биологическую функцию.
ДЕЗАМИНИРОВАНИЕ АМИНОКИСЛОТ
У человека происходит в основном путем окислительного дезаминирования. Эти реакции протекают с помощью двух ферментов:
- оксидаза Д-аминокислот
- оксидаза L-аминокислот
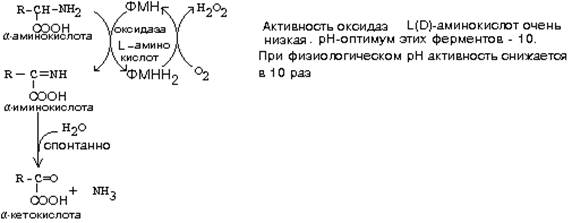
Эти ферменты обладают групповой стереоспецифичностью. Оксидазы отнимают протоны и электроны от аминокислот с помощью такого же механизма, как и оксидазы, обеспечивающие дезаминирование биогенных аминов. Эти ферменты являются флавопротеинами и содержат в качестве простетической группы ФАД или ФМН:
На первой стадии образуется иминокислота, а затем, после спонтанного гидролиза образуется альфа-кетокислота.
Кроме оксидаз имеется еще один фермент, катализирующий окислительное дезаминирование глутаминовой кислоты - глутамат-дегидрогеназа (глутаматДГ).
Этот фермент является НАД-зависимым и обладает высокой активностью (как и другие НАД-зависимые дегидрогеназы). В этом его отличие от оксидаз аминокислот, которые медленно превращают аминокислоты в физиологических условиях (поэтому в клетке сохраняется большинство аминокислот). Так как глутамат-ДГ является никотинамидной, то отнимаемые протоны и электроны не передаются сразу на кислород, а транспортируются по полной цепи МтО с образованием воды и параллельным образованием трех молекул АТФ.
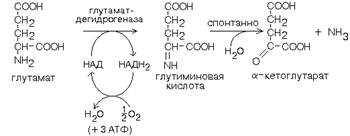
Глутамат-ДГ обладает высокой активностью и этим отличается от МАО и ДАО. Глутамат-ДГ является регуляторным ферментом - он ингибируется избытком АТФ, и активируется избытком АДФ.
БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ РЕАКЦИЙ ДЕЗАМИНИРОВАНИЯ
1. Реакции дезаминирования необратимы, как и реакции декарбоксилирования - дезаминирование тоже может играть роль первого этапа на путях распада аминокислот.
2. Один из непосредственных продуктов дезаминирования -конечный продукт метаболизма аммиак. Это токсическое вещество. Поэтому клетки должны затрачивать энергию, чтобы обезвредить аммиак до безвредных продуктов, которые выводятся из организма.
3. Другой продукт реакции дезаминирования - альфа-кетокислота.
Все образующиеся альфа-кетокислоты легко расщепляются дальше до СО2 и Н2О (например, аланин превращается в ПВК (путем дезаминирования; аспартат - в ЩУК; глутаминовая кислота - в альфа-кетоглутаровую). Большинство альфа-кетокислот тем или иным путем превращаются в кислоты, которые являются промежуточными метаболитами ЦТК:
- в альфа-кетоглутаровую;
- в янтарную;
- фумаровую;
-щавелево-уксусную. Все эти метаболиты могут в организме трансформироваться в углеводы, перед этим превращаясь в ПВК. Поэтому большинство аминокислот относится к группе, которая называется глюкогенными аминокислотами (их 17). Только 3 аминокислоты не могут превращаться в пируват, но превращаются в Ацетил-КоА – кетогенные аминокислоты: лейцин, лизин, триптофан). Они могут прямо трансформироваться в жирные кислоты или в кетоновые тела.
Метаболические пути, в которые вступают аминокслоты после дезаминирования, уже не являются собственно путями метаболизма аминокислот, а являются универсальными и для аминокислот, и для углеводов, и для жиров.
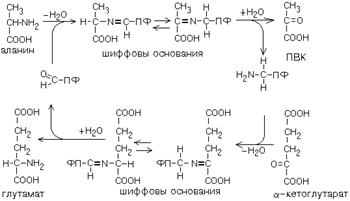
ТРАНСАМИНИРОВАНИЕ
Эта реакция заключается в том, что аминокислота и кетокислота обмениваются друг с другом своими функциональными группами при альфа-углеродном атоме. В результате вступившая в реакцию аминокислота превращается в соответствующую альфа-кетокислоту, а кетокислота становится аминокислотой.
Эту реакцию катализируют ферменты под названием ТРАНСАМИНАЗЫ (АМИНОТРАНСФЕРАЗЫ). Коферментом всех трансаминаз является активная форма витамина В6 - пиридоксальфосфат (фосфопиридоксаль).
ГЛАВНЫЕ ОСОБЕННОСТИ РЕАКЦИИ ТРАНСАМИНИРОВАНИЯ:
1. Это циклический процесс, все стадии которого катализируются одним и тем же ферментом - трансаминазой данной пары кислот. В этот цикл вступает одна аминокислота и кетокислота. Образуются другая альфа-кетокислота и аминокислота.
2. Все стадии этого процесса обратимы. Поэтому весь цикл в целом может протекать как в прямом, так и в обратном направлении. Направление этого цикла зависит от соотношения концентраций участников реакции - всех четырех кислот. Резко повысив концентрацию какой-либо одной из кислот, можно направить реакцию по определенному направлению.
3. Каждая трансаминаза обычно специфична для одной пары субстратов и соответствующей ей пары продуктов и все стадии реакции катализируются только одним ферментом. По участникам процесса для данного фермента дают ему название:
Фермент, который катализирует приведенную реакцию, можно назвать: Аланинаминотрансфераза (АлТ) (глутаминово-пировиноградная трансаминаза (ГПТ)).
4. Трансаминазы обычно обладают высокой субстратной специфичностью и высокой активностью. Наиболее активными в клетках являются те трансаминазы, для которых хотя бы один из субстратов является дикарбоновой альфа-кетокислотой - это АлТ - аланинаминотрансфераза (ГПТ) и АсТ - аспартатаминотрансфераза (ГЩТ).
Определение активности этих ферментов в сыворотке крови имеет важное значение в ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКЕ таких заболеваний, как ВИРУСНЫЙ ГЕПАТИТ и ИНФАРКТ МИОКАРДА.
АсТ и АлТ являются внутриклеточными ферментами. Поэтому в норме их активность в крови очень мала. При вирусном гепатите или при инфаркте миокарда наблюдается разрушение клеток печени или миокарда соответственно. Поэтому в крови будет наблюдаться повышение активности и АлТ, и АсТ, но неодинаковое для каждого из ферментов.
В клетках сердечной мышцы (миокарда) содержится гораздо больше АсТ, чем АлТ, а в клетках печени - наоборот: АлТ намного больше, чем АсТ. Поэтому ПРИ ИНФАРКТЕ МИОКАРДА АКТИВНОСТЬ АСТ в крови БУДЕТ ЗНАЧИТЕЛЬНО ВЫШЕ, ЧЕМ АЛТ, А ПРИ ВИРУСНОМ ГЕПАТИТЕ АКТИВНОСТЬ АЛТ БУДЕТ ВЫШЕ, ЧЕМ АСТ.
Поэтому определение активности этих ферментов в крови помогает врачам в постановке правильного диагноза.
БИОЛОГИЧЕСКАЯ РОЛЬ РЕАКЦИЙ ТРАНСАМИНИРОВАНИЯ.
1. ОБЕСПЕЧИВАЮТ СИНТЕЗ НОВЫХ АМИНОКИСЛОТ ИЗ ЧИСЛА ЗАМЕНИМЫХ. Из заменимых аминокислот также могут образоваться необходимые клетке кетокислоты.
Эта функция позволяет ругулировать содержание различных аминокислот в клетках организма (корректировка аминокислотного состава клеток).
При избытке какой-либо из кислот соотношение быстро восстанавливается трансаминазой за счет другой пары. Недостающее количество какой-либо из кислот может быть взято клеткой из других метаболических путей (например, альфа-кетоглутарат может быть взят из ЦТК). Избыток какой-либо из кислот может быть ликвидирован другими ферментами (например, избыточное количество глутамата окисляется глутаматдегидрогеназой).
2. ОБЕСПЕЧИВАЮТ ПРОТЕКАНИЕ РЕАКЦИЙ КОСВЕННОГО ДЕЗАМИНИРОВАНИЯ.
3. ОБЕСПЕЧИВАЮТ СИНТЕЗ МОЧЕВИНЫ
Date: 2015-05-23; view: 977; Нарушение авторских прав