
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Химические свойства кислот
1.Взаимодействие с индикаторами:
При диссоциации кислот образуются катионы водорода, поэтому индикаторы изменяют цвет. Например: HCl <==>H+ + Cl-
Н+ + лакмус → красный
Н+ + м/о → розовый
Н+ + ф/ф → бесцветный
2. Взаимодействие с металлами:
а) Fe + 2HCl → FeCl2 + H2↑
б) Cu + HCl → (См. электрохимический ряд напряжений металлов)
3. Взаимодействие с основными, амфотерными оксидами:
MgO + 2HCl → MgCl2 + H2O
ZnO + 2HCl →→ ZnCl2 + H2O
4. Взаимодействие с солями:
а) H2SO4 + Na2SiO3 → H2SiO3↓+ Na2SO4
б) H2SO4 + 2NaCl → Na2SO4 + 2HCl↑
конц. кристал.
5. С основаниями:
NaOH + HCl → NaCl + H2O
Получение кислот:
Кислоты можно получить взаимодействием:
1. Водорода с неметаллами:
Н2 + Cl2 → 2HCl
2. Кислотных оксидов с водой:
SO3 + H2O → H2SO4
3. Соли с кислотой:
а) AgNO3 + HCl → AgCl↓ + HNO3
б) NaNO3 + H2SO4 → HNO3 + NaHSO4
Соли.
Это продукты частичной или полной замены атомов водорода в кислоте на атомы металла, или продукты частичной или полной замены гидроксогрупп в основаниях на кислотные остатки.
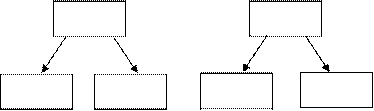
H2SO4 Cu(OH)2
NaHSO4 Na2SO4 CuOHCl CuCl2
Соли бывают:
Средние - а) это продукты полной замены атомов водорода в кислоте на металл, гидроксогрупп в основаниях на кислотные остатки.
б) это сложные вещества, состоящие из атомов металлов и кислотных остатков.
Na2SO4, NaCl, Ca3(PO4)2.
Кислые - а) это продукты частичной замены атомов водорода в кислоте на металл.
б) это сложные вещества, состоящие из атомов металлов, атомов водорода и кислотных остатков.
NaHSO4 - гидросульфат натрия.
Названия кислым солям дают следующим образом:
Атом водорода называют приставкой гидро-, затем дают название кислотному остатку и атому металла.
Одноосновные кислоты кислых солей не образуют.
Основные -
а) это продукты частичной замены гидроксогрупп в основаниях на кислотные остатки.
б) это сложные вещества, состоящие из атомов металлов, гидроксогрупп, кислотных остатков.
CuOHCl - гидроксохлорид меди (II).
Названия основным солям дают с использованием приставки гидроксо-, затем называют кислотный остаток и атомы металлов.
Одновалентные металлы основных солей не образуют.
Двойные - соли, содержащие в своем составе два или несколько видов атомов металлов и кислотные остатки:
| KCr(SO4)2 | KAl(SO4)2 | MgNH4PO4 |
| хромокалиевые квасцы сульфат калия, хрома (III). | алюмокалиевые квасцы сульфат калия, алюминия. | магния, аммония фосфат. |
Комплексные - соли, содержащие комплексный ион:
Na2[Zn(OH)4] тетрагидроксо-цинкат натрия.
Получение средних солей:
Средние соли получают при взаимодействии:
1. Основания с кислотой:
KOH + HNO3 → KNO3 + H2O
2. Кислоты с основным оксидом:
H2SO4 + CuO → CuSO4 + H2O
3. Кислоты с солями:
H2S + CuCl2 → CuS↓ + 2HCl
4. Двух различных солей:
Na2SO4 + BaCl2 →BaSO4↓ + 2NaCl
5. Щелочи с солями:
3КOH + FeCl3 → 3KCl + Fe(OH) 3↓
6. Основания с кислотными оксидами:
Сa(OH)2 + CO2 → CaCO3↓ + H2O
7. Основных оксидов с кислотными:
CaO + SiO2 → CaSiO3
8. Металлов с неметаллами:
2K + Cl2 → 2KCl
9. Металлов с кислотами:
2Al + 6HCl → 2AlCl3 + 3H2↑ (См. электрохимический ряд напряжений металлов)
10. Металлов с солями:
а) Fe + CuSO4 → FeSO4 + Cu
б) FeSO4 + Cu → (См. электрохимический ряд напряжений металлов)
11. Основной соли с кислотой:
MgOHCl + HCl →→ MgCl2 + H2O
12. При разложении кислых солей:
t
Ca(HCO3)2 → CaCO3↓ + CO2↑ + H2O
Получение кислых солей:
Кислые соли получают при взаимодействии:
1. Основания с избытком кислоты:
NaOH + H2SO4 → NaHSO4 + H2O
избыток
2. Средней соли с кислотой, кислотный остаток которой входит в состав соли:
Na2SO4 + H2SO4 → 2NaHSO4
3. Ангидрида в избытке со щелочью или с солью:
а) СО2 + NaOH →→ NaHCO3
избыток
б) СО2 + Na2CO3 + H2O→2NaHCO3
4. При получении соляной кислоты, при низкой температуре (450оС) образуется кислая соль:
t = 450oC
NaCl + H2SO4 → NaHSO4 + HCl
Получение основных солей:
Основные соли получают при взаимодействии:
1. Кислоты с избытком основания:
HCl + Mg(OH)2 → MgOHCl + H2O
избыток
2. Средней соли со щелочью:
Bi(NO3) 3 + 2NaOH → Bi(OH)2NO3 + 2NaNO3
дигидроксонитрат висмута (III)
Химические свойства солей:
1. Металл с солью:
Fe + CuSO4 → Cu + FeSO4
Cu + FeSO4 → (См. электрохимический ряд напряжений металлов)
2. Соль с солью (обе соли растворимы, одна из полученных солей должна выпадать в осадок):
BaCl2 + MgSO4 → BaSO4↓ + MgCl2
3. Соль с кислотой (если в осадок выпадает одна из солей):
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
4. Растворимая соль со щелочью (если образуется нерастворимое в воде основание):
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
5. Соль с неметаллами:
2NaBr + Cl2 → 2NaCl + Br2
6. Взаимодействие с оксидами:
t
Na2CO3 + SiO2 → Na2SiO3 + CO2↑
Date: 2015-05-22; view: 610; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |