
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Определение содержания никеля в растворе при помощи фотоэлектроколориметра
|
|
Цель занятия: Научиться определять концентрацию растворенных веществ фотоколориметрическим методом способом сравнения. Освоить технику подбора и приготовления эталонных буферных смесей с заданным значением рН. Научиться построению калибровочных графиков и определению с их помощью концентрации исследуемого раствора.
Теоретическая часть
Одними из оптических методов анализа, основанных на измерении оптических свойств систем, являются колориметрия, фотоэлектроколориметрия, спектрофотометрия - все это методы абсорбционного анализа.
Вещества поглощают и отражают электромагнитное излучение. Вещества, поглощающие часть излучения в пределах длин волн 400-760 нм, окрашены. Наряду с поглощением и отражением видимого света есть вещества поглощающие излучения в ультрафиолетовой (200-400 нм) и инфракрасной (0,8-25 мкм) областях спектра. Величина, характер поглощения и отражения света зависит от природы вещества и его концентрации в растворе. На этом основаны фотометрические методы качественного и количественного анализа исследуемых объектов.
Электромагнитное излучение, разложенное по длинам волн или по энергии, образует спектр.
Основные характеристики электромагнитного излучения. Свет имеет двойственную природу: волновую и корпускулярную. Волновые характеристики — это частота колебаний, длина волны и волновое число. Квантовая характеристика — это энергия квантов. Частота колебаний (ν) показывает число колебаний в одну секунду и измеряется герцах, мегагерцах. Длина волны (λ) показывает наименьшее расстояние между точками, колеблющимися в одинаковых фазах. Измеряется в метрах, нанометрах.
Длина волны и частота колебаний связаны между собой соотношением
ν =с / λ,
где с- скорость света.
Величина, обратная длине волны, называется волновым числом (ν') и выражается в обратных сантиметрах.
Энергия электромагнитного излучения (Дж/моль) определяется соотношением
Е = hv,
где h — постоянная Планка (6,62-10_34 Дж-с).
Абсорбционный спектральный анализ (Молекулярная абсорбционная спектроскопия).
Закон Ламберта — Бугера — Бера связывает уменьшение интенсивности света, прошедшего через слой светопоглощающего вещества, с концентрацией вещества и толщиной слоя:
I = I0 -ειс
где I и I0 — интенсивность света, прошедшего через раствор и растворитель соответственно; ε — молярный коэффициент светопоглощения; ι — толщина слоя; с — концентрация раствора.
Закон Ламберта — Бугера — Бера: оптическая плотность раствора прямо пропорциональна концентрации вещества и толщине поглощающего слоя.
Величина ε зависит от природы вещества, поглощающего свет, от выбранной длины волны и температуры
Отношение I / I0= Т, где Т — коэффициент светопропускания. Отрицательный десятичный логарифм этого отношения называют величиной оптической плотности -D:
D = -lg T
Взятый с обратным знаком логарифм Т называется оптической плотностью D, это есть
D = -lg T = ειс.
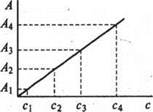
т.е. если светопоглощение раствора подчиняется закону Бугера-Ламберта-Бера, то оптическая плотность раствора при постоянной температуре прямо пропорциональна толщине слоя и величине молярного коэффициента и оптической плотности от концентрации выражается прямой линией, идущей от начала координат (рис.1). Если концентрация выражена в массовых единицах, тогда угловой коэффициент составит коэффициент поглощения K. Чем больше наклон градуировочного графика к оси концентраций, тем более чувствительным является данный фотометрический метод.
Можно рассчитывать ελ по результатам измерения оптической плотности раствора заданной концентрации по формуле
ελ = D min / ιс
Можно также использовать табличные данные.
Если же основной закон светопоглащения не соблюдается, то прямолинейная зависимость нарушается.
|
Рис. 8.1 Градуировочный график
Закон Бугера-Ламберта-Бера справедлив только для монохроматического излучения в средах с постоянным показателем преломления. В измеряемом растворе не должно происходить химических превращений (полимеризации, конденсации, гидролиза, диссоциации и т.д.). С изменением температуры молярный коэффициент поглощения изменяется сравнительно мало.
В зависимости от используемой аппаратуры фотометрические методы анализа делят на две группы: фотоколориметрический анализ и спектрофотометрический анализ.
Приборы, применяемые в спектрофотомерии (различного типа спектрофотометры), более сложны, чем приборы, используемые в фотоколориметрическиии (фотометры и фотоэлектроколориметры– ФЭКи).
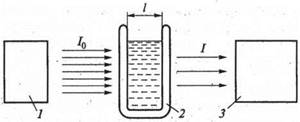
|
Рис.1 Схема фотометрического анализа:
1- Источник излучения; 2- кювета; 3- детектор
При фотоколориметрическом методе анализа измеряют поглощение световых лучей широких участков видимого спектра. При спектрофотометрическом анализе измеряют поглощение монохроматического света. Спектрофотометрический анализ используется для видимой, ультрафиолетовой и ближней инфракрасной областей спектра.
В зависимости от природы окрашенного вещества лучи с одной длиной волны поглощаются сильнее, а с другой длиной волны — слабее. В результате этого световой пучок, выходящий из раствора, окрашен в дополнительный цвет. Следовательно, визуально наблюдаемый цвет раствора является дополнительным к цвету поглощенных лучей. Связь цвета, прошедшего через раствор (окраска раствора), и цвета поглощенного светового потока представлена в табл, 1.
Для характеристики окрашенных растворов различных соединений используют их спектры поглощения (кривые светопоглощения). Для получения спектра поглощения (кривой светопоглощения), построенной в координатах оптическая плотность (D) — длина волны (λ), проводят серию измерений оптической плотности раствора при различных длинах волн. По полученным данным строят кривую (рис. 44).
Табл.1
| Цвет раствора и длина волны света, прошедшего через раствор, нм | Цвет и длина волны света, поглощенного раствором, нм | ||
| Фиолетовый | 400-450 | Желто-зелёньга | 550-575 |
| Синий | 450г-480 | Желтый | 575-585 |
| Зелено-синий | 480-490 | Оранжевый | 585-620 |
| Сине-зеленый | 490-500 | Красный | 620-750 |
| Зеленый | 500-560 | Пурпурный (красно-голубой) | |
| Желто-зеленый | " 550-575 | Фиолетовый | 400-450 |
| Желтый | 575-585 | Синий | 450-480 |
| Оранжевый | 585-620: | Зелено-синий | 480-490 |
| Красный | 620-750 | Сине-зеленый | 490-500 |
| Пурпурный (красно-голубой) | Зеленый | 500-560 |
Длина волны, при которой отмечается максимум поглощения света, обозначается через λmax. При работе с разбавленными окрашенными растворами измерение их оптической плотности желательно проводить в той области спектра, в которой поглощение лучей определяемым веществом является максимальным. Это позволяет произвести количественное определение вещества с наибольшей точностью и чувствительностью. Для того чтобы из всей видимой части спектра выделить лучи определенных длин волн, на пути света перед поглощающими растворами помещают светофильтры. Светофильтры
подбирают, исходя из спектра поглощения определяемого вещества, так, чтобы спектральная область максимального поглощения лучей окрашенным раствором и область максимального пропускания лучей светофильтром была одной и той же, т.е. максимум поглощения раствора должен совпадать с максимумом пропускания (минимумом поглощения) светофильтра (см. табл. 1)
Фотоколориметрия. Метод основан на измерении интенсивности немонохроматического светового потока, прошедшего через анализируемый раствор, с помощью фотоэлементов в фотоколориметрах и в фотоэлектроколориметрах. Световой поток от источника излучения (обычно — лампы накаливания) проходит через светофильтр, пропускающий излучение лишь в определенном интервале длин волн, через кювету с анализируемым раствором и попадает на фотоэлемент, преобразующий световую энергию в фототок, регистрируемый соответствующим прибором. Чем больше светопоглощение анализируемого раствора (т.е. чем выше его оптическая плотность), тем меньше энергия светового потока, попадающего на фотоэлемент.
Фотоэлектроколориметры снабжаются несколькими светофильтрами, имеющими максимум светопропусканий при различных длинах волн.
Разработаны различные конструкции фотоэлектроколориметров, предназначенных для работы в ближней УФ и в видимой (преимущественно) области спектра. Светофильтры (чаще всего это стекла различного состава и окраски) пропускают излучение шириной в несколько десятков нм – от 20 до 50 нм.
Наиболее распространенными являются фотоэлектроколориметры с одним или с двумя фотоэлементами. Фотоэлектроколориметры с одним фотоэлементом предусматривают измерение энергии однолучевого светового потока. Приборы с двумя фотоэлементами измеряют энергию двух световых потоков (двухлучевая схема), один из которых проходит через анализируемый раствор, а другой — через, раствор сравнения («нулевой» раствор).
Фотоэлектроколориметры позволяют проводить измерение оптической плотности или пропускания раствора только с несколькими светофильтрами, поэтому с их помощью нельзя получить непрерывный спектр поглощения в том или ином спектральном диапазоне.
Концентрацию определяемого вещества в анализируемом растворе находят либо с использованием основного закона светопоглощения, предварительно установив концентрационный интервал его выполнимости при заданных светофильтре и толщине поглощающего слоя, либо методом градуировочного графика. В последнем случае строгая выполнимость основного закона светопоглощения необязательна.
Относительная ошибка фотоколориметримеского определения концентрации обычно не превышает ±3%.
Метод обладает сравнительно высокой чувствительностью и хорошей воспроизводимостью, селективностью, прост по выполнению измерений оптической плотности или пропускания, использует относительно несложную аппаратуру. Однако немонохроматичность регистрируемого светового потока несколько понижает точность и воспроизводимость аналитических измерений.
Фотоэлектроколориметрия получила широкое распространение в аналитической практике, например, при анализе таких лекарственных препаратов, как диэтилстильбэстрол, левомицетин, ментол, новокаин, пилокарпина гидрохлорид, рутин, стрептомицин, этакридина лактат и многие другие.
Спектрофотометрия. Этот метод, применяемый чаще других и наиболее совершенный среди методов абсорбционного молекулярного анализа, основан на использовании специальных спектральных приборов—спектрофотометров, позволяющих регистрировать световые потоки в- широком интервале изменения длин волн от -185 нм. до ~1100 нм, т.е. в УФ, видимой и ближней ИК области спектра, и обеспечивающих высокую степень монохроматичности света (-0,2—5 нм), проходящего через анализируемую среду.
В большинстве спектрофотометров, применяемых в аналитической практике, монохроматизация светового потока осуществляется, за счет использования диспергирующих (разлагающих свет в спектр) элементов-призм или дифракционных решеток. Разработаны различные конструкции спектрометров, работающих как по однолучевой (одноканальной) так и по двухлучевой (двухканальной) схеме.
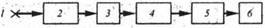
Рис. 2. Принципиальная блок-cxeмa спектрофотометра:
I — источник излучения; 2—монохроматор; 3— кюветное отделение; 4— приемник излучения (фотоэлементы); 5 – усилитель; 6 – регистратор (отсчетное или записывающее устройство)
На рис. 2 показана принципиальная блок-схема, включающая основные узлы; обеспечивающие работу спектрофотометра.
Свет от источника излучения l попадает в монохроматор 2, в котором он разлагается в спектр. Монохроматизованный световой поток проходит после этого через кюветное отделение 3, в котором устанавливаются кюветы с анализируемым раствором и раствором сравнения («нулевым» раствором). Пройдя через кюветы с растворами, световой поток попадает на фотоэлементы приемника излучения 4, в котором энергия светового потока преобразуется в фототок, усиливаемый в блоке усилителя 5, после чего усиленный электрический сигнал регистрируется в блоке регистратора 6 либо в виде спектральной кривой, либо по показанию отсчитывающего устройства.
В качестве источника излучения в спектрофотометрах используют лампы накаливания при работе в видимой области спектра, в которой они обеспечивают непрерывный световой поток (а не линейчатый, даваемый ртутной лампой), и водородные либо дейтериевые лампы — при работе в УФ диапазоне спектра (-200—350 нм).
Для разложения светового луча в спектр в монохроматоре чаще всего используют, как уже говорилось выше, призмы или дифракционные решетки. При работе в видимой и в ближней ИК области используют стеклянные призмы, а также стеклянные конденсоры (линзы) и кюветы. При работе в УФ диапазоне -200—400 нм применяют кварцевую оптику (призмы, конденсоры, кюветы), так как стекло поглощает УФ лучи.
При использовании спектрофотометров, работающих по однолучевой схеме, в световой поток в кюветном отделении попеременно вносят кювету с раствором сравнения (нулевым раствором) и кювету с анализируемым раствором. В кюветное отделение спектрофотометров, работающих по двухлучевой схеме, устанавливают одновременно обе кюветы: кювету с нулевым раствором — в канал сравнения, кювету с анализируемым раствором — в измерительный канал.
Обе кюветы — с нулевым и с анализируемым растворами — должны быть совершенно одинаковыми, с равной толщиной поглощающего слоя. При толщине поглощающего слоя l = 1 см допустимое отклонение не должно превышать ∆ l = ±0,005 см при температуре (20±1) °С. Обе кюветы, заполненные чистым растворителем, должны иметь одинаковую оптическую плотность при одной и той же длине волны.
Погрешность измерения длин волн на обычных спектрофотометрах составляет ±2 нм в области 200-800 нм.
Градуировку спектрофотометров по оптической плотности(или по пропусканию) контролируют по стандарту- сернокислому раствору дихромата калия(K2Cr2O7 и некотор.др.)
Разработаны различные приемы спектрофотометрии — прямая (непосредственная), дифференциальная, производная спектрофотометрия, спектрофотометрическое титрование.
Концентрацию определяемого вещества в анализируемом растворе при спектрофотометрических измерениях находят, как и в фотоэлектро- колориметрии, с использованием либо основного закона светопоглоще- ния, либо градуировочных графиков.
Спектрофотометрические методы обладают, по сравнению с фото- электроколориметрическими, большей точностью и чувствительностью, позволяют проводить анализ многокомпонентных систем без разделения компонентов; определять вещества, не поглощающие в видимой области спектра (но имеющие полосы поглощения в УФ диапазоне). Относительные ошибки спектрофотометрических определений не превышают ±2%.
В отличие от фотоколориметрии и фотоэлектроколориметрии, спектрофотометрия позволяет не только проводить измерение оптической плотности при фиксированной длине волны, но и получать спектры поглощения в широком спектральном диапазоне.
Из всех фотометрических методов спектрофотометрия применяется наиболее широко при анализе самых различных объектов неорганической и органической природы.
Лабораторная работа 1.
Цель занятия: Научиться определять концентрацию растворенных веществ фотоколориметрическим методом способом сравнения. Освоить технику подбора и приготовления эталонных буферных смесей с заданным значением рН. Научиться построению калибровочных графиков и определению с их помощью концентрации исследуемого раствора.
Для фотоколориметрического определения также готовят серию стандартных растворов, для каждого из них при помощи ФЭК определяют оптическую плотность и строят калибровочный график: на оси абцисс откладывают концентрацию, на оси ординат- оптическую плотность. Затем измеряют оптическую плотность определяемого раствора и по калибровочному графику находят концентрацию, отвечающую данной оптической плотности.
Определение основано на том, что ионы Ni2+ в щелочной среде, в присутствии окислителя (персульфат аммония, бром или др.) образуют с диметилглиоксимом (реактив Чугаева) внутрикомплексное соединение, окрашенное в оранжевый цвет.
Приготовление стандартного раствораNiS04 ∙ 7Н20. В 1 л стандартного раствора должно содержаться 0,02∙ 1000 = 20 мг или 0,02 г Ni. Моль NiS04∙ 7H20= 280,69 г:
в 280,69 г NiS04∙ 7Н20 содержится 58,69 г Ni
» х» NiS04∙ 7Н20» 0,02» Ni
х = 280,69∙ 0,02/58,69 = 0,09572 г.
Навеску 0,09572 г NiS04∙ 7H20 (х. ч.) количественно переносят в мерную колбу вместимостью1 л, растворяютв 200—250 мл дистиллированной воды, подкисляют 2-3 каплями концентрированной серной кислоты и доводят объем раствора до метки дистиллированной водой. Полученный раствор содержит 0,02 мг/мл Ni2+.
Построение калибровочного графика. В пять пронумерованных мерных колб вместимостью 100 мл приливают из бюретки (или вводят градуированной пипеткой) соответственно 2, 4, 6, 8 и 10 мл стандартного раствора NiS04∙ 7H20, что отвечает 0,04; 0,08; 0,12; 0,16 и 0,20 мг никеля. В каждую колбу цилиндром отмеривают по 10 мл 5%-ного раствора КОН, содержимое колб взбалтывают, добавляют по 10 мл 3%-ного свежеприготовленного раствора персульфата аммония и вновь перемешивают. В каждую колбу добавляют по 10 мл 1%-ного щелочного раствора диметилглиоксима, растворы окрашиваются в красно-оранжевый цвет, их перемешивают и доводят объемы до метки дистиллированной водой. Через 10 мин после приготовления растворов приступают к измерениям их оптической плотности на фотоэлектроколориметре. Измерения удобно вести в кювете с толщиной слоя раствора 30 мм, используя зеленый светофильтр (область пропускания 450—480 нм). В качестве раствора сравнения используют дистиллированную воду.
Измерив оптическую плотность всех пяти растворов, строят калибровочный график. На оси абсцисс откладывают содержание Ni2+, на оси ординат — величину оптической плотности.
Ход определения. Получив контрольный раствор соли никеля в мерной колбе вместимостью 100 мл, приливают к нему 10 мл 5%-ного раствора КОН, после перемешивания добавляют 10 мл 3 %-ного раствора персульфата аммония и, хорошо взболтав, прибавляют 10 мл 1%-ного щелочного раствора диметилглиоксима. Объем раствора доводят до метки дистиллированной водой, хорошо перемешивают и через 10 мин измеряют оптическую плотность в кювете с толщиной слоя 30 мм, используя зеленый светофильтр. Измерения повторяют трижды и по среднему значению оптической плотности, используя калибровочный график, находят содержание никеля в 100 мл раствора. В качестве раствора сравнения используют дистиллированную воду.
| На рис. 44 приведен график зависимости оптической плотности (оптическая плотность обозначена через D1; D2 и т. д.) от концентрации никеля. Предположим, в результате трех измерений получено среднее значение оптической плотности D1. Из точки D4 проводим прямую, параллельную оси абсцисс до пересечения с прямой MN. Из точки пересечения К опускаем перпендикуляр на ось абсцисс и получаем значение концентрации Ni2+: 0,12 мг/100 мл. | 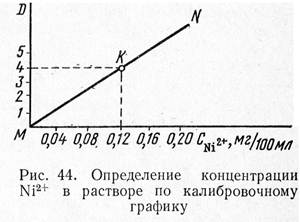
|
Правила работы на приборе:
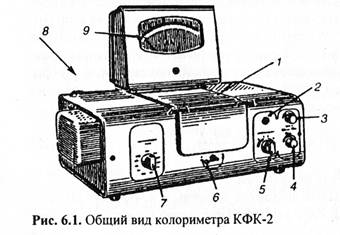
За 15 мин до начала измерений фотоколориметр (см. рис 6.1) подключают к электросети, открывают крышку кюветного отделения 1 и, нажимая кнопку «Сеть»8, включают прибор, при этом загорается индикаторная лампа 2. Поворотом ручки «Светофильтры» 7 устанавливают необходимый светофильтр. Ручку чувствительности 5 устанавливают в положение «1», отмеченное черным цветом. Ручку «Установка 100 грубо» 4 переводят в крайнее левое положение.
После включения прибора готовят растворы для фотоколориметрирования. Пробирки и кюветы перед проведением анализа тщательно моют и ополаскивают дистиллированной водой. Кюветы можно брать только за те грани, через которые при работе фотометра не проходит луч света.
В первую пробирку с помощью пипетки отмеривают 9,0 мл исследуемого раствора, а во вторую пробирку добавляют из бюретки 9,0 мл раствора карбоната натрия. В обе пробирки добавляют точно (из бюретки) по 1,0 мл раствора выбранного индикатора. Содержимое пробирок хорошо перемешивают стеклянной палочкой.
Одну из кювет заполняют раствором из первой пробирки, предварительно ополоснув ее этим раствором, а другую кювету — дистиллированной водой. Жидкости в кюветы наливают до метки. При необходимости внешние стенки кювет осушают фильтровальной бумагой.
Кювету с дистиллированной водой помещают в дальнее отделение кюветодержателя, а кювету с исследуемым раствором — в ближнее отделение. Рычаг смены кювет 6 должен находиться в положении «1». Крышку кюветного отделения закрывают и вращением ручек «Чувствительность», «Установка 100 грубо» и «Установка 100 точно» 3 устанавливают стрелку микроамперметра 9 положение «0» по нижней шкале «Д». Перемещают рычаг смены кювет 6 в положение «2» и записывают полученное по нижней шкале значение оптической плотности в лабораторный журнал. Измерение повторяют.
После окончания измерения оптической плотности исследуемого раствора кювету с этим раствором извлекают из прибора, раствор выливают, кювету промывают дистиллированной водой, ополаскивают раствором из второй пробирки и заполняют этим же раствором. Кювету ставят в ближнее отделение и измеряют оптическую плотность щелочного раствора индикатора аналогично тому, как было описано выше.
По окончании измерений обе кюветы вынимают из прибора и моют дистиллированной водой. Прибор выключают.
Лабораторная работа 2
Спектрофотометрическое определение хрома
и марганца при совместном присутствии в растворе
прямым методом
Цель работы: Научиться определять в растворе концентрации двух
компонентов при наличии в их спектрах поглощения участков в которых
поглощается лишь один из компонентов
Оборудование: шт
1. Спектрофотометр; 1
2. Измерительные кюветы с l =1см; 4
3. Мерные колбы на 100мл; 3
4. Бюретки на 25мл в штативах; 3
Растворы:
1. Стандартный раствор KMnO4 с концентрацией 2∙10-4 моль/л -100мл
2. Стандартный раствор K2Cr2O7 концентрацией 1, 66 ∙10-3 моль/л -100мл
Задание: Установить концентрации перманганата и бихромата калия
в заданном растворе.
Сущность работы: одновременное определение концентрации двух веществ (хрома и марганца) при их совместном присутствии основано на различии спектров поглощения окрашенных растворов перманганат- и дихромат-ионов. Спектры поглоще 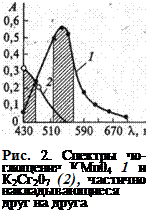 ния определяемых ионов частично накладываются друг на друга (рис. 2). В) этом случае при фотометрировании с разными светофильтрами можно. Пренебречь светопоглощением лишь одного из компонентов окрашенной смеси. При 550 ± 20 нм поглощает преимущественно перманганат-ион и оптическая плотность D55Q обусловлена только перманганат-ионом (незначительным светопоглощением дихромат-иона пренебрегаем). При 430 ± 20 нм поглощают оба аниона и оптическая плотность раствора D430 аддитивно(суммарно) складывается из оптической плотности, обусловленной перманганат-ионом, и оптической плотности, обусловленной дихромат-ионом.
ния определяемых ионов частично накладываются друг на друга (рис. 2). В) этом случае при фотометрировании с разными светофильтрами можно. Пренебречь светопоглощением лишь одного из компонентов окрашенной смеси. При 550 ± 20 нм поглощает преимущественно перманганат-ион и оптическая плотность D55Q обусловлена только перманганат-ионом (незначительным светопоглощением дихромат-иона пренебрегаем). При 430 ± 20 нм поглощают оба аниона и оптическая плотность раствора D430 аддитивно(суммарно) складывается из оптической плотности, обусловленной перманганат-ионом, и оптической плотности, обусловленной дихромат-ионом.
Если в растворе присутствует несколько окрашенных веществ, не взаимодействующих между собой, то каждое вещество поглощает свет независимо от других. Суммарное поглощение при данной длине волны Dλ равно сумме поглощений отдельных компонентов при той же длине волны. Этот принцип положен в основу анализа смесей окрашенных веществ. При λ =const и l =const имеем:
D = (εАсА + εВсВ+ …) ι
Ход выполнения работы
1. Определяем молярные коэффициенты поглощения (погашения)
(ε) KMnO4 и K2Cr2O7 при λ= 430нм и λ= 550нм (KMnO4), т.к. при этих
длинах волн одно из веществ поглощает минимально(рис. 2-спектры поглощения перманганата и бихромата калия)
Для этого измеряем оптические плотности стандартных растворов при λ=430нм и λ=550нм.
Результаты измерений вносим в таблицу 1.
Таблица 1 – Результаты измерений
| Измерения | Среднее | |||
| λ= 430нм D K2Cr2O7 | ||||
| λ= 430нм KMnO4 | ||||
| λ= 550нм KMnO4 |
Расчеты молярных коэффициентов поглощения:
ε 430 K2Cr2O7 = D / ιс
ε430 KMnO4= D / ιс
ε430 KMnO4= D / ιс
2. Определяем концентрации KMnO4 и K2Cr2O7 в заданном растворе. Для этого трижды измеряем оптические плотности заданного раствора при λ=430нм и λ==550нм. Результаты этих измерений вносим в таблицу 2.
Таблица 2- Результаты измерений
| Измерения | Среднее | |||
| D 430 | ||||
| D 550 |
Вычисляем молярную концентрацию С KMnO4
СKMnO4 = D 550 / ε KMnO4 ∙λ
Вычисляем молярную концентрацию C K2Cr2O7 из формулы:
D430= ε KMnO4∙СKMnO4 + ε K2Cr2O7 ∙ СK2Cr2O7
СK2Cr2O7 = D430 - ε KMnO4∙СKMnO4 / ε K2Cr2O7
Контрольные вопросы
Контрольные вопросы
1.Чем отличаются физико-химические методы анализа от химических?
2.На чем основан принцип работы фотоэлектроколориметра?
3.Что такое оптическая плотность раствора и как она выражается?
4.В чем сущность метода стандартных серий?
5.Как строится калибровочный график?
6.Каким образом по калибровочному графику можно определить концентрацию исследуемого раствора?
7. Какие методы анализа входят в группу спектральных методов? Кратко охарактеризуйте их
8. Абсорбционная Спектроскопия. Спектры поглощения. Основной закон светопоглощения (закон Ламберта — Бугера — Бера). Отклонения от закона Ламберта — Бугера — Бера.Что называется спектром поглощения и в, каких координатах его представляют?
9.Что называется коэффициентом пропускания Т и оптической плотностью D? В каких пределах изменяется их величина?
10. Каков физический смысл молярного коэффициента светопоглощения? Какие факторы влияют на его величину?
6. Что представляют собой кулевые растворы или растворы сравнения? С какой целью их используют? Как выбирают длину волны и светофильтры при фотометрическом методе анализа?
7.Вычислите оптическую плотность раствора хлорида меди (II) с концентрацией 0,01000 моль/д с толщиной поглощающего слоя 1 см (е = 100).
8. Каково применение изученных методов анализа?
Date: 2015-05-18; view: 6942; Нарушение авторских прав