
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Виды молекул
|
|
Для понимания природы химической связи, обуславливающей образование молекул из атомов, а также кристаллов, необходимо рассмотреть квантовомеханическую модель атома с учетом волновых свойств электронов. Взаимодействие классических зарядов полностью описывается законом Кулона. Электрическое взаимодействие реальных электронов, обладающих волновыми свойствами, не может быть сведено к обычному кулоновскому.
Рассмотрим, что происходит при сближении атомов. Во-первых, экспериментально доказано, что силы, удерживающие атомы в молекулах, вызваны взаимодействием внешних электронов. Электроны внутренних оболочек при этом остаются в прежних состояниях. Во-вторых, волновые функции внешних электронов довольно быстро, но плавно убывают при удалении от ядра. При сближении атомов размытые электронные облака внешних электронов перекрываются, что приводит к особому виду взаимодействия. Это взаимодействие не имеет аналога в классической физике – для классических зарядов проблема взаимного проникновения тел вообще не возникает. Оно проявляется в области перекрытия электронных облаков отдельных атомов. В такой ситуации появляется добавочная (помимо кулоновской) энергия взаимодействия электронов – «обменная энергия». При этом если спины электронов параллельны, энергия положительна, а электроны отталкиваются, препятствуя образованию молекулы. Если же спины электронов антипараллельны, обменная энергия отрицательна, и электроны притягиваются и будут стремиться образовать единую оболочку, которая окружит оба ядра. Ядра будут удерживаться на некотором расстоянии за счет сил кулоновского отталкивания.
В атомах гелия два электрона заполненной К -оболочки обладают противоположными спинами, поэтому они не соединяются ни друг с другом, ни с другими атомами. Гелий – инертный газ. Два атома лития могут образовать молекулу, объединяя электроны L -слоя в одну оболочку. При этом электроны К -оболочек будут отталкиваться по тем же причинам, по которым отталкиваются атомы гелия. То есть химически активными будут лишь те электроны, которые не имеют парных по спину. Энергетически выгодное объединение электронов с противоположными спинами приводит к образованию молекулярной связи. Следует отметить, что атомы гелия вообще могут образовывать молекулу, но для этого необходимо, чтобы оба атома были в возбужденном состоянии – в первом и во втором слоях будет по одному неспаренному электрону. Такая молекула будет неустойчивой, поскольку энергия двух невозбужденных атомов будет меньше энергии молекулы.
Рассмотрим атом бериллия (Z = 4). В невозбужденном состоянии, согласно рис. 8.2, он не обладает неспаренными электронами – строение его второй оболочки такое же, как у химически инертного атома гелия.
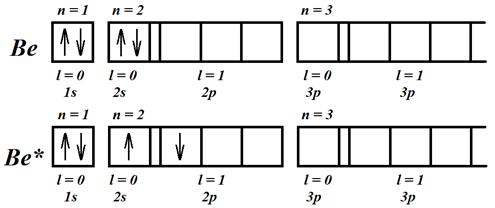
Рис. 8.2. Электронная конфигурация атома бериллия
в основном и возбужденном состоянии
Однако, как показывает опыт, атом бериллия двухвалентен. Он, как и атом гелия, может обладать валентными электронами при возбуждении. Один из электронов атома гелия при возбуждении должен перейти на следующую оболочку, для этого требуется энергия ~ 20 эВ, которая не перекрывается обменной энергией, выделяющейся при образовании молекулы.
При возбуждении атома бериллия возникают два валентных электрона в результате перехода одного из них из s -состояния в p -состояние в пределах одной оболочки (рис. 8.2). Это требует малой энергии, многократно перекрываемой за счет обменной энергии, выделяемой при образовании молекулы. Если молекула образуется за счет объединения валентных электронов в единую электронную оболочку, принято говорить о ковалентной химической связи. Электронное облако, образующееся при этом, обладает симметрией относительно обоих атомов.
Другой тип молекулярной связи можно показать на примере молекулы NaF. У атома натрия первые две оболочки завершены, на третьей (n = 3) оболочке имеется один s -электрон, энергия связи которого составляет 5.12 эВ. В атоме фтора завершена только первая оболочка, а на второй имеются 7 электронов, при этом один спин не насыщен. Поэтому атом фтора может легко присоединить восьмой электрон, перетянув его от атома натрия, и стать отрицательно заряженным ионом. Атом натрия при этом становится положительным ионом. Такой тип молекулярной связи называется ионной химической связью.
Энергия обменного взаимодействия в случае молекулы NaF составляет 4.13 эВ – это меньше энергии связи электрона в атоме натрия, и на первый взгляд образование данной молекулы энергетически не выгодно. Однако образовавшиеся ионы разных знаков при малых расстояниях (порядка 5Å) обладают энергией связи 2.9 эВ. Таким образом, энергия, удерживающая атомы в молекуле, оказывается равной 4.13 + 2.9 = 7.03 эВ, что значительно превышает энергию связи электрона в атоме (5.12 эВ). От взаимного проникновения ионы удерживаются отталкиванием завершенных оболочек.
Молекулярной связи чисто ионного типа не существует, говорят о доли ионности и ковалентности. Но, если молекула состоит из одинаковых атомов, она имеет место чисто ковалентный тип связи.
Молекула является квантовой системой, для нее можно записать и решить уравнение Шредингера. Сложность уравнения сильно увеличивается при увеличении числа составляющих системы (электронов и ядер).
Рассмотрим самую простую из молекул – молекулу водорода. В ее состав входят два электрона и два протона (два ядра). Потенциальная энергия такой системы равна:
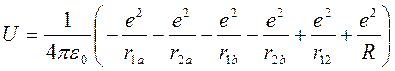 (8.14)
(8.14)
Ядра имеют массу, приблизительно в 2000 раз превышающую массу электрона. Поэтому в первом приближении ядра можно считать неподвижными. Такое приближение позволяет, значительно упростив, свести уравнение Шредингера к следующему виду:
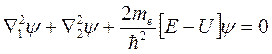 (8.15)
(8.15)
где U – потенциальная энергия (6.1), 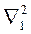 – оператор Лапласа, содержащий координаты одного электрона, а
– оператор Лапласа, содержащий координаты одного электрона, а 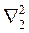 – оператор Лапласа, содержащий координаты другого электрона. Если считать, что движения ядер и электронов не зависят друг от друга, то уравнение (8.15) распадается на два независимых уравнения, одно из которых описывает состояние ядер, другое – состояние электронов.
– оператор Лапласа, содержащий координаты другого электрона. Если считать, что движения ядер и электронов не зависят друг от друга, то уравнение (8.15) распадается на два независимых уравнения, одно из которых описывает состояние ядер, другое – состояние электронов.
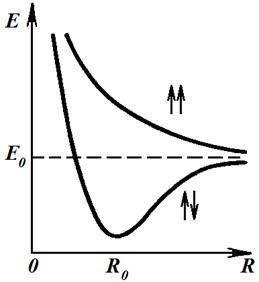
Рис. 8.3. Энергия молекулы в зависимости от расстояния между атомами
Полная энергия движения и взаимодействия электронов в системе из двух атомов водорода оказывается зависящей от расстояния между ядрами атомов. Причем зависимость имеет различный характер при сближении атомов с параллельными или антипараллельными спинами. При удалении ядер друг от друга в обоих случаях наблюдается асимптотическое приближение энергии системы к значению E0, равному сумме энергий двух атомов. Эта величина равна энергии связи молекулы, соответственно именно такая энергия необходима, чтобы разрушить молекулу (энергия диссоциации).
При сближении атомов, валентные электроны в которых имеют параллельные спины, наблюдается увеличение полной энергии системы двух атомов. В этом случае возможно только взаимное отталкивание атомов.
В случае сближения атомов с противоположно ориентированными спинами существует минимум энергии, который и соответствует образованию молекулы. Этот минимум определяется разницей между суммой энергий двух атомов и энергией их взаимодействия. Расстояние R0 определяет равновесное расстояние между ядрами в молекуле для данной электронной конфигурации. При изменении электронной конфигурации молекулы, например при переходе молекулы в возбужденное состояние, меняется зависимость электронной энергии от расстояния между ядрами U*(r) (рис. 8.4). Это выражается в частности в том, что меняется равновесное расстояние между ядрами атомов, входящих в состав молекулы. Меняется также и энергия диссоциации молекулы.
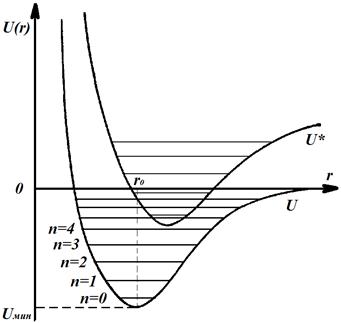
Рис. 8.4. Потенциальные кривые молекулы в основном и возбужденном состоянии
Возможные изменения энергии молекулы определяются тремя видами движения, характерными для молекул.
1) При изменении электронной конфигурации (то есть в результате изменения периферической части молекулы) происходит наиболее заметное изменение энергии молекулы. Эту долю энергии обозначают как электронную энергию Ee.
2) При заданной электронной конфигурации молекулы, ядра могут совершать колебательные движения относительно положения равновесия.
Можно определить энергию колебательного движения ядер, она квантуется и при малых колебаниях равна:
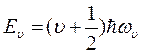 (υ = 0, 1, 2,...) (8.16)
(υ = 0, 1, 2,...) (8.16)
где ωυ – классическая частота осциллятора,
υ – колебательное квантовое число, изменение которого при переходах подчиняется правилу отбора: ∆υ = ± 1 (8.17)
3) Наконец, необходимо учитывать, что молекула как целое совершает вращательное движение относительно центра масс. Такая система имеет момент инерции, и ее движение может быть описано с помощью угловой скорости ωr. В этом случае энергия будет равна:
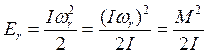 (8.18)
(8.18)
где I – момент инерции молекулы относительно оси, проходящей через центр масс.
M = Jωr – момент импульса системы, который также может принимать лишь определенные дискретные значения, поскольку молекула является системой с квантовыми свойствами:
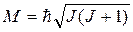 (J = 0, 1, 2,...) (8.19)
(J = 0, 1, 2,...) (8.19)
здесь J – квантовое число момента импульса или вращательное квантовое число.
Таким образом, значение вращательной энергии оказывается квантуемым: 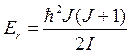 (8.20)
(8.20)
Энергетические переходы молекулы происходят согласно правилу отбора вращательного квантового числа:  (8.21)
(8.21)
Таким образом, полная энергия молекулы равна:
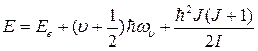 (8.22)
(8.22)
Каждое из слагаемых полной энергии любой молекулы имеет определенный порядок величины, и определяет расстояние между соответствующими уровнями на энергетической схеме молекулы. Электронная энергия Ee составляет величину порядка нескольких эВ (1 – 10 эВ); колебательная энергия – Eυ ≈ 0.01 – 0.1 эВ; вращательная энергия – Er ≈ 10–5 – 10–3 эВ.
Спектры молекул, в отличие от линейчатых спектров атомов, представляют собой набор полос, состоящих из нескольких линий. В зависимости от того, изменение какого вида энергии происходит при испускании молекулой фотона, различают три вида полос: вращательные, колебательно-вращательные и электронно-колебательные.
Электронно-колебательные переходы в спектрах молекул имеют наибольшую энергию (порядка нескольких эВ). В данных переходах задействованы электронные уровни энергии, (E'e и E''e на рис. 7.5), а также колебательные уровни (например υ' = 1 и υ'' = 0 или любые другие колебательные уровни, но обязательно один должен быть из колебательных подуровней электронного состояния E'e, другой из колебательных подуровней электронного состояния E''e). Для полос электронно-колебательного типа характерно наличие резкого края с одной стороны, называемого кантом полосы, и размытого края с другой.
Полосы, соответствующие колебательно вращательным переходам расположены в диапазоне энергий от 0.01 эВ до 1.5 эВ. При этом положение полосы в спектре (т.е. ее частоту или длину волны или энергию) определяет колебательная составляющая (это могут быть два колебательных состояния υ' = i и υ' = i ± 1 одного и того же электронного уровня). Вращательная составляющая J изменяется в пределах данного колебательного уровня и определяет тонкую структуру полосы (т.е. наличие и взаимное расположение линий в пределах данной полосы).
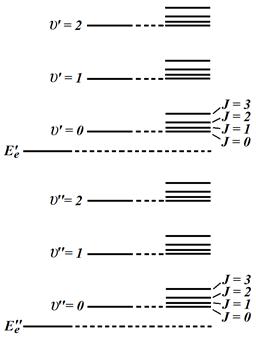
Рис. 8.5. Энергетическая схема молекулы
Вращательные полосы состоят из линий, соответствующих переходам между только вращательными состояниями в пределах одного колебательного уровня. Энергия фотона, под действием которого возможны такие переходы довольно мала (порядка 0.001 эВ), следовательно вращательные полосы расположены в далекой инфракрасной области.
Спектры молекул так же индивидуальны для различных органических и неорганических соединений, как спектры различных атомов. Накопленный учеными-спектроскопистами опыт позволяет по спектру излучения молекул (или смеси молекул) определить наличие и даже процентное содержание конкретного вещества в пробе. Важной особенностью подобных методов является низкий порог чувствительности – даже наличие очень малого количества какого-либо вещества доступно для исследования. Это широко используется в настоящее время для экспертного анализа во многих лабораториях. В качестве примера можно привести допинг-контроль на спортивных соревнованиях; криминалистические экспертизы на содержание наркотических веществ в крови или непосредственно идентификация найденного вещества как наркотического или напротив, как разрешенного медицинского препарата; экспертиза товаров народного потребления (продуктов питания, бытовой химии, любых предметов) на содержание вредных и запрещенных соединений.
Date: 2015-05-18; view: 1120; Нарушение авторских прав