
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Подземных вод
|
|
Основной формой выражения результатов химического анализа воды является весовая ионная форма, которая является исходной для получения других форм выражения химических анализов воды. В этой форме в виде соответствующих таблиц результаты анализов проб воды поступают в производственные организации (см. табл. 3.4).
Таблица 3.4
Результаты химического анализа подземных вод
| Катионы, мг/л | Анионы, мг/л | Растворенные газы, мг/л | |||||
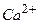
| 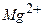
| 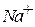 + + 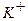
| 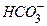
| 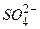
| 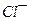
| 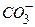
| |
| 42,9 | 13,2 | 47,6 | 195,2 | 74,1 | 15,9 | 13,2 | |
Для полного выявления свойств воды и точного представления о соотношении ионов результаты анализов переводят из весовой в эквивалентную форму – в миллиграмм-эквиваленты ионов в 1 л.
Для перевода мг/л в мг/экв в 1 л воды необходимо количество каждого иона разделить на его эквивалентный вес (частное от деления ионного веса на валентность).
Например, по данным анализа, содержание 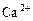 составляет 42,9 мг/л. Атомный вес
составляет 42,9 мг/л. Атомный вес 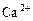 – 40,08, валентность – 2, то эквивалентный вес этого иона буде равен 40,08: 2 = 20,04. Значит, в эквивалентной форме выражение анализа содержание кальция будет составлять 42,9 мг/л: 20,04 = 2,14 мг-экв/л.
– 40,08, валентность – 2, то эквивалентный вес этого иона буде равен 40,08: 2 = 20,04. Значит, в эквивалентной форме выражение анализа содержание кальция будет составлять 42,9 мг/л: 20,04 = 2,14 мг-экв/л.
Вместо деления на эквивалентный вес часто производят умножение количества миллиграммов иона в 1л на величину, обратную эквивалентному весу. Эта величина называется пересчетным коэффициентом. Так, пересчетный коэффициент для 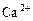 будет составлять 1:20,04 = 0,0499. Пересчетные коэффициенты наиболее часто встречающихся ионов приведены в таблице 3.5.
будет составлять 1:20,04 = 0,0499. Пересчетные коэффициенты наиболее часто встречающихся ионов приведены в таблице 3.5.
Таблица 3.5
Пересчетные коэффициенты основных катионов и анионов
| Пересчетный коэффициент | Катионы | Анионы | |||||
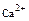
| 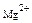
| 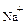
| 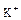
| 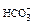
| 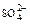
| 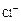
| 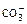
|
| 0,0499 | 0,0822 | 0,0438 | 0,0256 | 0,0164 | 0,0208 | 0,0282 | 0,0333 |
Для выражения результатов химического анализа в процент-эквивалентной форме сумму катионов и сумму анионов в миллиграмм-эквивалентной форме принимают за 100 % каждую. Далее с помощью пропорции определяют процентное содержание каждого катиона и аниона.
Так как вода является природным химическим раствором, находящимся в подвижном равновесии, то ионы противоположного знака взаимодействуют друг с другом, как уже говорилось, в эквивалентных количествах.
Поэтому сумма катионов в эквивалентной форме должна равняться сумме анионов. Если суммы не равны, то либо пересчет сделан неправильно, либо анализ проведен не точно. Допустимое расхождение сумм анионов и катионов не должно превышать 5 %.
В нашем случае:
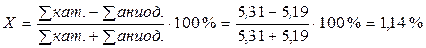 .
.
Результаты пересчетов результатов химического анализа воды приведены в таблице 3.6.
Таблица 3.6
Результаты обработки химического анализа подземных вод
| Форма выражения анализа | Анионы | Сумма | Катионы | Сумма | Жесткость | Минерализация | Водородный показатель pH | Растворенные газы | Название воды | |||||
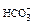
| 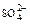
| 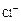
| 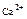
| 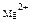
| Na++ K+ | мг-экв/л | град | |||||||
| мг/л | 195,2 | 74,1 | 15,9 | 42,9 | 13,2 | 47,6 | 7,2 | 13,2 | Сульфатно-гидрокарбонатная Натриевокалиевая кальциевая | |||||
| мг-экв/л | 3,20 | 1,54 | 0,45 | 5,19 | 2,14 | 1,09 | 1,22 | 5,31 | 3,23 | 9,03 | ||||
| % мг-экв/л | 61,7 | 29,7 | 8,6 | 40,3 | 20,4 | 39,3 |
Для систематизации химических анализов подземных вод используются многочисленные классификации, графические методы изображения состава подземных вод и формулы. Однако в настоящее время отсутствует единая классификация химического состава подземных вод. В связи с этим, предлагается большое количество классификаций вод по их ионному и компонентному составу, химическим свойствам и др.
Рассмотрим наиболее распространенные классификации подземных вод по их химическому составу и свойствам.
Минерализация воды – это сумма всех найденных при химическом анализе воды минеральных веществ. О величине минерализации судят по сухому остатку, который получается после выпаривания определенного объема воды и выпаривания его при температуре 110 °С. Минерализация выражается в мг/л и г/л.
По величине минерализации природные воды подразделяются на 6 групп (см. табл. 3.7).
Таблица 3.7
Классификация природных вод по величине минерализации
| Группа природных вод | Минерализация, г/л |
| Сверхпресные | менее 0,2 |
| Пресные | 0,2−1,0 |
| Слабосолоноватые | 1–3 |
| Сильносолоноватые | 3−10 |
| Соленые | 10−35 |
| Рассолы | более 35 |
По величине минерализации вода, химический анализ которой представлен в табл. 3.6, относятся к пресным.
Водородный показатель (pH) показывает концентрацию водородных ионов принято выражать показателем pH, представляющим собой отрицательный десятичный логарифм концентрации иона Н +: pH = −lg [ Н +]. Практически показатель pH равен показателю степени концентрации ионов водорода взятому с обратным знаком. По величине водородного показателя природные воды подразделяются на 7 групп (см. табл. 3.8).
Таблица 3.8
Классификация природных вод по величине водородного показателя
| Группа природных вод | Водородный показатель (pH) |
| Сильнокислые | менее 1,9 |
| Кислые | 1,9−4,0 |
| Слабокислые | 4,1−6,9 |
| Нейтральные | |
| Слабощелочные | 7,1−8,2 |
| Щелочные | 8,3−10,3 |
| Сильнощелочные | более 10,3 |
По величине водородного показателя вода относится к слабощелочным.
Жесткость воды обуславливается содержанием в воде ионов 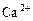 и
и 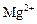 . Для вод, используемых в хозяйственных и технических целях, жесткость имеет большое значение. Величина жесткости выражается в мг-экв/л, либо в немецких градусах (1 мг-экв/л равен 2,8 немецких градусов).
. Для вод, используемых в хозяйственных и технических целях, жесткость имеет большое значение. Величина жесткости выражается в мг-экв/л, либо в немецких градусах (1 мг-экв/л равен 2,8 немецких градусов).
Различают общую, временную (устранимую) и постоянную (неустранимую) жесткость воды.
Общая жесткость определяется суммарным содержанием в воде ионов 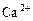 и
и 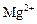 . Временная жесткость обусловлена наличием в воде гидрокарбонатных и карбонатных солей кальция и магния. Для ее определения сравнивают между собой содержание в воде
. Временная жесткость обусловлена наличием в воде гидрокарбонатных и карбонатных солей кальция и магния. Для ее определения сравнивают между собой содержание в воде 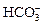 и сумму
и сумму 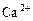 и
и 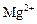 . В том случае, если содержание гидрокарбонатного иона больше суммы ионов кальция и магния, то величина устранимой жесткости будет равна сумме этих ионов и наоборот. Постоянная жесткость равна разности между величинами общей и временной жесткости.
. В том случае, если содержание гидрокарбонатного иона больше суммы ионов кальция и магния, то величина устранимой жесткости будет равна сумме этих ионов и наоборот. Постоянная жесткость равна разности между величинами общей и временной жесткости.
По величине общей жесткости природные воды подразделяются на 5 групп (табл. 3.9).
Таблица 3.9
Классификация природных вод по величине общей жесткости
| Группа природных вод | Общая жесткость, мг-экв/л |
| Очень мягкие | менее 1,5 |
| Мягкие | 1,5−3,0 |
| Умеренно жесткие | 3,1−6,0 |
| Жесткие | 6,1−9,0 |
| Очень жесткие | более 9,0 |
Общая жесткость воды, результаты химического анализа которой представлены в табл. 6.1, будет равна 3,23 мг-экв/л или 9,03 °С, временная жесткость также будет равна 3,23 мг-экв/л (т.к. 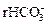 <
< 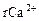 +
+ 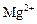 ). По величине общей жесткости вода относится к умеренно жестким водам.
). По величине общей жесткости вода относится к умеренно жестким водам.
Для графического изображения результатов химического состава и систематизации анализов наибольшее распространение получили графики-прямоугольники, циклограммы, графики-треугольники, а также представление химического состава воды в виде формулы М.Г.Курлова.
Для наглядного изображения данных химического состава используется формула М.Г. Курлова, которая представляет собой псевдодробь, в числителе которой слева направо записывают анионы и их содержание (в % мг-экв/л) в порядке убывания. В знаменателе таким же способом записываются катионы. Количество катионов и анионов округляется до целых чисел. Для более четкого представления об условиях формирования химического состава вод в формуле указываются все анионы и катионы, содержание которых превышает 1 % мг-экв/л. Слева от дроби записывается величина общей минерализации в граммах на литр, а если имеются элементы, специфичные для данного химического анализа (газы, активные элементы и др.), то их количества (в г/л) записывают перед минерализацией. Справа от дроби записываются величины pH, дебита воды (в л/с) и температура воды в градусах Цельсия.
В наименование состава воды указываются те компоненты, содержание которых более 25 % мг-экв/л. В начале пишут название воды по преобладающему аниону (если анионов с содержанием 25 % мг-экв/л два и более, то название воды пишут через черточку от меньшего содержания к большему), затем добавляют название типа воды по преобладающим катионам и пишут их через черточку по тому же принципу.
Так, химический состав воды, результаты химического анализа которой представлены в табл. 3.6, будет обозначаться следующей формулой:
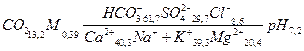 .
.
Название воды, состав которой приведен в записанной выше формуле, будет: сульфатно-гидрокарбонатная натриево-калиевая кальциевая.
График-прямоугольник представляет собой два вертикальных прямоугольника на одном из которых в масштабе нанесены % мг-экв/л анионов, на другом - % мг-экв/л катионов, в последовательности, определяемой относительной реакционной силой (для анионов: 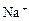 +
+ 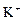 ,
, 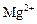 ,
, 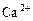 ; для катионов:
; для катионов: 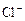 ,
, 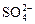 ,
, 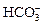 ) (см. рис. 3.5).
) (см. рис. 3.5).
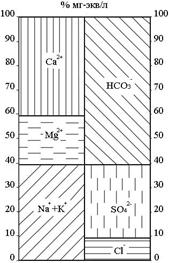 |
Рис. 3.5. График-прямоугольник химического состава воды
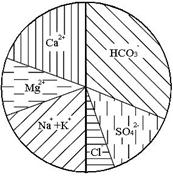 При построении циклограмм, вычерчивается окружность, диаметр которой в масштабе равен величине минерализации воды. Окружность разбивается на две половины вертикальной плоскостью, площадь левой половины круга соответствует 100 % содержания катионов, а площадь правой – 100 % содержания анионов. Содержание каждого иона показывается в виде сектора, площадь которого пропорциональна его содержанию в % мг-экв/л (см. рис. 3.6).
При построении циклограмм, вычерчивается окружность, диаметр которой в масштабе равен величине минерализации воды. Окружность разбивается на две половины вертикальной плоскостью, площадь левой половины круга соответствует 100 % содержания катионов, а площадь правой – 100 % содержания анионов. Содержание каждого иона показывается в виде сектора, площадь которого пропорциональна его содержанию в % мг-экв/л (см. рис. 3.6).
Рис. 3.6. График-прямоугольник химического состава воды
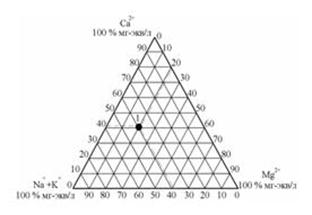
Для изображения результатов массовых химических анализов вод используют графики-треугольники (см. приложение 2), на которых показывается содержание катионов и анионов. Методика построения подобных графиков подробно изложена в п.п. 3.2.
Построенные точки одного анализа подписываются одинаковой цифрой. Графики-треугольники, показанные на рис. 3.6, построены по данным результатов химического анализа (см. табл. 3.7).
 |
Рис. 3.7. Графики-треугольники химического состава воды
Вредное (разрушающее) воздействие подземных вод на материал сооружений (бетон, железобетон, металл и т.д.) называется агрессивностью.
В зависимости от химических соединений, обуславливающих разрушающее воздействие, различают следующие виды агрессивности: углекислую, выщелачивающую, сульфатную, магнезиальную и общекислотную.
Углекислая агрессивность заключается в разрушении бетона в результате растворения карбонатов кальция (СаСО3) под действием свободной углекислоты (СО2). Данный вид агрессивности проявляется при содержании агрессивной СО2 в концентрациях более 3 мг/л.
Выщелачивающая агрессивность проявляется в виде растворения карбонатов кальция (СаСО3) и выщелачивания гидрооксида кальция (Са(НО)2).
Подземные воды считаются агрессивными при содержании 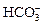 менее 1,5 мг-экв/л.
менее 1,5 мг-экв/л.
Сульфатная агрессивность проявляется в виде вспучивания и разрушения бетона, под действием солей серной кислоты. Проявляется при содержании в водах ионов 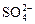 в концентрации более 250 мг/л.
в концентрации более 250 мг/л.
Магнезиальная агрессивность отмечается при высоких содержаниях ионов Mg2+, более 1000 мг/л. Бетон при этом вспучивается и разрушается.
Общекислотная агрессивность выражается в виде разрушения металлических частей сооружений и установок подземными водами с водородным показателем (рН) менее 7.
Рассматриваемая подземная вода проявляет углекислую агрессивность, так как содержание СО2 превышает значение 3 мг/л.
Date: 2015-04-23; view: 5918; Нарушение авторских прав