
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Многоэлектронные атомы
|
|
Описание поведения даже только двух электронов в атоме оказывается непосильной задачей для современной вычислительной науки, поэтому предполагается, что любой многоэлектронный атом похож (энергетические уровни, форма орбиталей и другие свойства) на атом водорода. Однако для такого предположения приходится вводить целый ряд дополнительных теоретических предпосылок. Тщательное изучение структуры спектральных линий атомов показало, что два электрона, имеющие одинаковые значения трех квантовых чисел n, l и m, т. е. одну и ту же энергетическую характеристику, форму областей максимальной вероятности нахождения электрона и одинаковую ориентацию, могут различаться друг от друга некоторым особым магнитным свойством, которое не поддается объяснению с точки зрения классической механики. Из-за того, что это свойство обусловливает собственный магнитный момент электрона, раньше считали, что два электрона на одной орбитали вращаются вокруг своей оси в различных направлениях, например, по часовой стрелке и против. Это «вращение» характеризуется величиной, которая называется спин, он может иметь два противоположных направления. Спину электрона отвечает спиновое квантовое число, которое обозначим s (в научной литературе часто пользуются обозначением ms). Спиновое квантовое число s может принимать два значения:
s = +1/2 и s = –1/2.
Не путайте спиновое квантовое число с обозначением s-орбитали!
Электроны с положительным или отрицательным спиновым числом обозначают стрелками, направленными вверх или вниз, которые помещают в квадрат, изображающий орбиталь. Ниже представлен атом водорода с одним электроном на первом энергетическом уровне, или, что в данном случае одно и то же, на s-подуровне, в основном (невозбужденном) состоянии со спиновым квантовым числом s = +1/2:
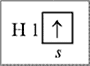
Для атома водорода, т. е. для системы «один протон и один электрон», спин электрона не влияет на энергетические характеристики атома, но без представления о спине не удается объяснить образования молекулы водорода Н2 из двух атомов водорода. Молекула водорода образуется, если сталкивающиеся атомы водорода имеют:
энергию активации, достаточную для преодоления сил отталкивания одноименно заряженных электронных оболочек;
в момент столкновения третью частицу, забирающую избыточную энергию молекулы;
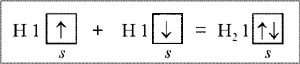
противоположные по знаку спины (спиновые квантовые числа) двух электронов, что в данный момент является самым главным.
Только атомы с двумя противоположными спинами способны взаимодействовать друг с другом (рис. 1).
|
| Рис. 1. Модель реакции между двумя атомами водорода (ковалентный способ образования химической связи) |
Вам понятна эта схема образования молекулы водорода? Попытайтесь письменно изложить ее суть.
Заметим, эта схема универсальна для возникновения ковалентной связи, когда каждый атом отдает на образование химической связи по одному электрону. Область перекрывания электронных оболочек двух атомов находится на равном расстоянии от двух одинаковых ядер, поэтому данная связь одновременно является и неполярной. Забегая вперед и вспоминая ранее изученный материал, заметим, что при разных ядрах атомов зона перекрывания электронных оболочек смещается в сторону одного из ядер. Такая связь называется полярной. При очень сильном смещении зоны перекрывания к ядру одного из атомов связь называется ионной.
У атомов, имеющих больше одного электрона, не может быть двух и более электронов с одинаковыми значениями всех четырех квантовых чисел. Это – принцип Паули, или запрет Паули. Любые два электрона в атоме должны отличаться по крайней мере значением одного из четырех квантовых чисел. Двум электронам атома запрещено быть во всех отношениях похожими друг на друга, поэтому в одной электронной ячейке не может находиться два электрона с одинаковыми значениями спинового квантового числа, например  , и больше двух электронов, например три. Если бы это случилось, то возникло бы состояние
, и больше двух электронов, например три. Если бы это случилось, то возникло бы состояние 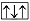 , но это не подтверждено ни теоретически, ни экспериментально. Таким образом, в одной ячейке (или на одной орбитали) может находиться не более двух электронов, причем только с противоположными спинами.
, но это не подтверждено ни теоретически, ни экспериментально. Таким образом, в одной ячейке (или на одной орбитали) может находиться не более двух электронов, причем только с противоположными спинами.
Сейчас некоторые философы и естествоиспытатели пытаются перенести явления и законы микромира на такие сложные объекты, как организм и даже жизнь человека и общества. Попытайтесь и вы найти аналогию принципу Паули в жизни людей.
Два электрона, находящиеся на одной орбитали, или в одной ячейке, и имеющие различные по знаку значения спинового квантового числа, называются спаренными 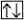 . Электроны, размещенные по одному на орбиталях, называются неспаренными. Наличие спаренных или неспаренных электронов в атомах, молекулах и кристаллах устанавливается экспериментально путем изучения магнитных свойств вещества. Вещества с неспаренными электронами парамагнитны. Эти вещества намагничиваются во внешнем магнитном поле по направлению поля, и поэтому магнитное поле втягивает эти вещества. Парамагнитными являются атомы водорода, а также часто упоминавшаяся ранее молекула диоксида азота NO2, имеющая один неспаренный электрон.
. Электроны, размещенные по одному на орбиталях, называются неспаренными. Наличие спаренных или неспаренных электронов в атомах, молекулах и кристаллах устанавливается экспериментально путем изучения магнитных свойств вещества. Вещества с неспаренными электронами парамагнитны. Эти вещества намагничиваются во внешнем магнитном поле по направлению поля, и поэтому магнитное поле втягивает эти вещества. Парамагнитными являются атомы водорода, а также часто упоминавшаяся ранее молекула диоксида азота NO2, имеющая один неспаренный электрон.
Вещества со всеми спаренными электронами диамагнитны. Они намагничиваются навстречу направлению действующего на них внешнего магнитного поля, которое их выталкивает. Диамагнитными являются атомы гелия, молекулы водорода, тетраоксида диазота N2О4 и др.
Изучение магнитных свойств вещества в ряде случаев позволяет определить возраст минерала или изделия, что используется в археологии. Один из методов датировки древних эпох, когда не было письменности, заключается в измерении остаточной намагниченности подвергшихся обжигу изделий из глины (посуда, кирпичи и т. п.).
Увеличение числа электронов в атоме подчиняется определенным законам, что приводит к строгому расположению элементов в периодической таблице Д.И.Менделеева и периодическому повторению их свойств. Ранее не раз упоминались некоторые основные положения электронного строения атомов. Повторим их и кратко рассмотрим новые.
1. Подобие энергетических электронных уровней атомов уровням атома водорода. Поскольку точный расчет электронного строения двух- и многоэлектронных атомов пока невозможен, предполагается, что их электронные уровни и подуровни расположены, как в атоме водорода. Это предположение имеет исключения.
2. Принцип наименьшей энергии. При заполнении электронами уровней и подуровней последовательность размещения электронов должна отвечать как наименьшей энергии электрона, так и наименьшей энергии атома в целом. Электрон не занимает вышележащий уровень, если в нижележащем есть ячейки, располагаясь в которых, он будет обладать меньшей энергией. Этот принцип выражает общее термодинамическое требование к устойчивости системы: максимуму устойчивости системы соответствует минимум ее энергии. Но помните также и о том, что в состоянии максимальной устойчивости электронной системы в атоме связь электронов с ядром наиболее прочна. Чем ближе к ядру находится электрон, тем прочнее его связь с ядром.
3. Правило n + l, или правило Клечковского. Энергия электрона в атоме определяется значениями главного n и побочного l квантовых чисел, поэтому сначала заполняются электронами те энергетические уровни и подуровни, для которых сумма значений квантовых чисел n + l минимальна. Если для двух подуровней одного или разных уровней суммы n + l равны, то сначала заполняется подуровень с меньшим значением n.
4. Правило Гунда (Хунда). Заполнение электронами ячеек p-, d- и f -подуровней вначале происходит неспаренными электронами, и лишь после такого заполнения подуровня начинается вхождение в ячейки вторых электронов (с противоположными спиновыми квантовыми числами), т. е. происходит их спаривание.
Спокойная очередь входит в пустой автобус. Каждый пассажир вначале занимает одно место двухместного сиденья, а когда такие места заканчиваются, пассажиры начинают подсаживаться на свободные места к уже сидящим. В столовой почему-то вы выбираете столик, за которым никто не сидит, но, когда таких столиков нет, вы подсаживаетесь вторым. Неужели законы квантовой механики сказываются на поведении людей?
Принцип Паули и правило Гунда свидетельствуют о неизвестном и непонятном нам информационном взаимодействии между электронами. Каждый электрон как будто знает о состоянии другого электрона в атоме (и, наверное, в молекуле).
5. Повышенная устойчивость подуровней. Незаполненные, наполовину заполненные и полностью заполненные подуровни обладают повышенной устойчивостью.
На рис. 2 показан порядок заполнения электронных уровней и подуровней многоэлектронных атомов, найденный при подсчете сумм n + l, с учетом других теоретических положений.
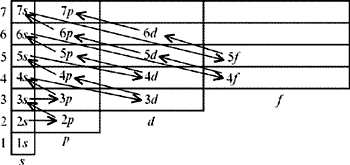
|
| Рис. 2. Порядок заполнения электронных уровней и подуровней многоэлектронных атомов |
Теперь мы можем обсудить причины проявления элементом той или иной валентности. Согласно спиновой теории валентности валентность элемента определяется числом неспаренных электронов невозбужденного и возбужденного атома. На рис. 3 показаны энергетические диаграммы атомов фтора (а), хлора (б) и марганца (в).
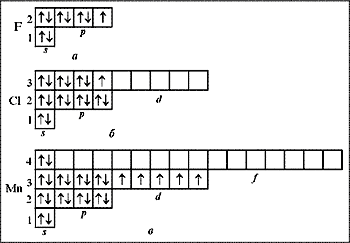
|
| Рис. 3. Энергетические электронные диаграммы атомов: а – фтора; б – хлора; в – марганца |
У атома фтора только один неспаренный электрон на 2 р -подуровне. Возбуждение атома с целью перевода электронов с 2 р -подуровня на более высокий уровень с n = 3 невозможно, т. к. энергии химической реакции недостаточно для такого процесса. В связи с этим фтор в своих соединениях всегда одновалентен.
У атома хлора энергетический электронный уровень с n = 3 состоит из трех подуровней: s, p и d. Один неспаренный электрон невозбужденного атома хлора располагается на 3 p -подуровне, и в таком состоянии хлор, как и фтор, одновалентен (хлороводород НСl, хлорид натрия NaCl, хлорид-ион Cl–, оксид хлора Cl2О, хлорноватистая кислота HСlO, соли-гипохлориты, гипохлорит-ион).
Электроны с 3 s - и 3 p -подуровней атома хлора могут при достаточной энергии возбуждения переходить, распариваясь, на 3 d -подуровень, что показано стрелками на рис. 4. В результате последовательно образуется: три неспаренных электрона и соответственно проявляется трехвалентное состояние (хлористая кислота НСlO2, соли-хлориты, хлорит-ион), пять неспаренных электронов и проявляется пятивалентное состояние (хлорноватая кислота НСlO3, соли-хлораты, хлорат-ион), семь неспаренных электронов и проявляется семивалентное состояние хлора (оксид хлора Cl2O7, хлорная кислота НСlO4, соли-перхлораты, перхлорат-ион).
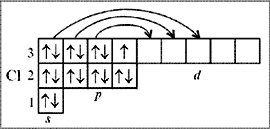
|
| Рис. 4. Валентности (спиновые) хлора |
Кислородные кислоты хлора – хороший пример изменения кислотных и окислительных свойств в зависимости от валентного состояния элемента. В ряду кислот HСlO – НСlO2 – НСlO3 – НСlO4 четко видно усиление кислотных свойств (хлорная кислота НСlO4 – самая сильная неорганическая кислота), ослабление окислительной активности (кинетика) в разбавленных водных растворах и усиление окислительных свойств (термодинамика) в концентрированных водных растворах.
Почему марганец и хлор находятся в одной группе периодической таблицы элементов Д.И.Менделеева? Эти элементы расположены в разных подгруппах: хлор – в главной, марганец – в побочной. Марганец находится в 4-м периоде, и в атоме его четыре главных энергетических уровня (см. рис. 3, в). Два спаренных электрона находятся на 4 s -подуровне и пять неспаренных – на 3 d -подуровне. У марганца несколько валентностей, но наиболее часто имеют дело с соединениями, в которых он двух- и семивалентен. Эти валентности проявляются при распаривании 4 s -электронов. К соединениям двухвалентного марганца относятся MnO, MnCl2, MnSO4, семивалентного – перманганат калия KMnO4 и перманганат-ион 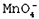 .
.
Растворы перманганата калия («марганцовка») используют для дезинфекции ран (это лучше, чем раствор йода, но хуже пероксида водорода) и иногда для тонирования древесины. Раствор перманганата калия не очень интенсивного фиолетового цвета можно принимать внутрь при желудочных заболеваниях, если отсутствуют другие более сильные средства, но нужно помнить, что соединения марганца способствуют разжижению крови и приводят к ее трудной свертываемости.
Ниже мы будем пользоваться понятием спиновой валентности для объяснения состава и структуры простейших соединений.
Периодичность свойств элементов наиболее ярко выражается в структуре электронных уровней и подуровней атомов и проявляется в зависящих от них свойствах. Свойства сложных атомных систем (молекулы, кристаллы) слагаются из свойств, которые могут изменяться в противоположных направлениях, поэтому явление периодичности или закономерное изменение свойств таких систем по периоду или подгруппе элементов часто не обнаруживается (в учебниках и научных статьях, однако, чаще всего приводятся данные, подтверждающие закон периодичности).
Свойства элементов, определяемые электронной структурой атома, изменяются периодически, как и сама структура атома.
Простейшей химической реакцией, характеризующей свойства свободных атомов, является процесс отрыва электрона (электронов) от невозбужденного атома:
Э = Э++ е,
чему отвечает 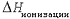 , или I.
, или I.
Изменение энтальпии 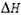 в этом процессе равно количеству энергии, необходимой для отрыва электрона от невозбужденного атома, т. е. равно энергии ионизации I. Энергия ионизации характеризует способность атома удерживать электроны, что является важной характеристикой химической активности элемента. Для многоэлектронных атомов определены энергии ионизации, отвечающие последовательным отрывам электронов: I1, I2, I3 и т. д.
в этом процессе равно количеству энергии, необходимой для отрыва электрона от невозбужденного атома, т. е. равно энергии ионизации I. Энергия ионизации характеризует способность атома удерживать электроны, что является важной характеристикой химической активности элемента. Для многоэлектронных атомов определены энергии ионизации, отвечающие последовательным отрывам электронов: I1, I2, I3 и т. д.
Иногда, чаще всего в физике, пользуются потенциалами ионизации, которые определяют как наименьшее напряжение электрического поля, при котором начинают из атомов образовываться положительно заряженные ионы и электроны. Потенциалы ионизации выражают в эВ/атом, при этом
1 эВ/атом = 1,602•10–19 Дж/атом. Умножим это число на число Авогадро и получим значение 96,48 кДж/моль. Энергия ионизации, выраженная в электрон-вольтах, численно равна энергии ионизации, выраженной в вольтах. Энергии ионизации и потенциалы ионизации, выраженные в одинаковых единицах измерения, численно равны. Например, потенциал ионизации атома водорода равен 13,59 эВ, или 13,59 В. Умножив это число на коэффициент перевода 96,48, получим 13,59•96,48 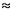 1311 кДж/моль.
1311 кДж/моль.
Обычно удаление электрона из атома тем легче, чем больше номер периода элемента, т. е. чем дальше от ядра находится электрон. Вдоль по периоду первые энергии ионизации атомов элементов возрастают, но не равномерно, что видно из
рис. 5.
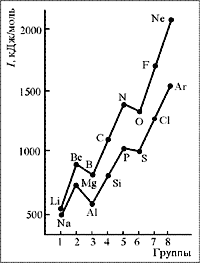
|
| Рис. 5. Энергии ионизации атомов элементов 2-го и 3-го периодов |
От лития к бериллию энергия ионизации возрастает (заполнение 2 s -подуровня), затем немного понижается к бору (начинается заполнение 2 р -подуровня), а от него почти линейно возрастает к азоту (произошло заполнение 2 р -подуровня одиночными электронами), после которого немного снова понижается у кислорода, а затем резко повышается к неону. Второй энергетический уровень заполнен и очень стабилен.
Внешний электрон у атома натрия связан с ядром слабее, чем у атома лития, и при дальнейшем повышении числа электронов в атоме примерно повторяется ход зависимости энергии ионизации от числа электронов для атомов второго периода. Даже такое упрощенное обсуждение ионизационных потенциалов еще раз доказывает правильность квантовых представлений об электронной структуре атомов.
Квантовые числа
Главное квантовое число n обозначает номер уровня.
n = 1÷7 (K-Q). Целое число, характеризует энергию электронов, занимающих данный уровень.
n = 1 - Энергия минимальна
n = 7 - Энергия максимальна, электроны слабо связаны с ядром.
N = 2n2,
где N - максимальное число электронов на уровне, n - номер уровня (главное квантовое число).
Орбитальное = побочное квантовое число l - целое от 0 до n - 1, определяет форму орбитали.
l = 0 – s-орбиталь, шарообразная форма
l = 1 – p-орбиталь, форма объемной восьмерки («гантель»)
l = 2 – d-орбиталь, более сложная форма
l = 3 – f-орбиталь, -«-
Электроны с одинаковым l в пределах одного уровня образуют подуровни. Они отличаются энергией связи с ядром. Их число на уровне равно n, но не более 4.
Подуровни обозначают буквами:
s-подуровень – 1 орбиталь,
p-подуровень – 3 орбитали,
d-подуровень – 5 орбиталей,
f-подуровень – 7 орбиталей.
Элементы, у которых происходит заполнение определенного подуровня, называются соответственно s,p,d,f-элементами.
s-элементы – элементы главных подгрупп 1 и 2 групп и гелий.
p-элементы – элементы главных подгрупп 3-8 групп
d-элементы - элементы вставных декад (переходные элементы)
f-элементы – лантаноиды и актиноиды.
Магнитное квантовое число m определяет расположение орбитали в пространстве (по осям координат).
m принимает значения от –l до +l, включая 0. Число значений, принимаемых m, определяет число орбиталей на подуровне:
l = 0, m = 0 – 1 s-орбиталь
l = 1, m = -1,0,+1 - 3 p-орбитали
l = 2, m = -2,-1,0, +1,+2 – 5 d-орбиталей
l = 3, m = -3,-2,-1,0,+1,+2,+3 – 7 f-орбиталей
Принцип Паули. В атоме не может быть 2 электронов, все 4 квантовых числа которых были бы одинаковыми. Поэтому на каждой орбитали может находиться не более 2 электронов.
Date: 2015-05-17; view: 1906; Нарушение авторских прав