
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Квантовые числа электрона
|
|
Квантовое число n – главное. Оно определяет энергию электрона в атоме водорода и одноэлектронных системах (He+, Li2+ и т. д.). В этом случае энергия электрона
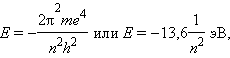
|
где n принимает значения от 1 до ∞. Чем меньше n, тем больше энергия взаимодействия электрона с ядром. При n = 1 атом водорода находится в основном состоянии, при n > 1 – в возбужденном.
В многоэлектронных атомах электроны с одинаковыми значениями n образуют слой или уровень, обозначаемый буквами K, L, M, N, O, P и Q. Буква K соответствует первому уровню, L – второму и т. д.
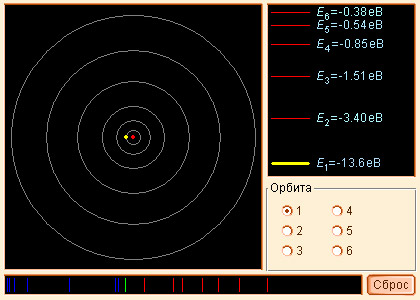
|
| Модель 2.2. Атом водорода |
Орбитальное квантовое числоl характеризует форму орбиталей и принимает значения от 0 до n – 1. Кроме числовых l имеет буквенные обозначения
| l | = | … | |||||
| l | = | s | p | d | f | g | … |
Электроны с одинаковым значением l образуют подуровень.
Квантовое число l определяет квантование орбитального момента количества движения электрона 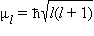 в сферически симметричном кулоновском поле ядра.
в сферически симметричном кулоновском поле ядра.
Квантовое число ml называют магнитным. Оно определяет пространственное расположение атомной орбитали и принимает целые значения от – l до + l через нуль, то есть 2 l + 1 значений. Расположение орбитали характеризуется значением проекции вектора орбитального момента количества движения Mz на какую-либо ось координат (обычноось z):
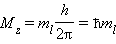
|
Все вышесказанное можно представить таблицей:
| ||||||||||||||||||
| Таблица 2.1 Число орбиталей на энергетических подуровнях |
Орбитали одного подуровня (l = const) имеют одинаковую энергию. Такое состояние называют вырожденным по энергии. Так p -орбиталь – трехкратно, d – пятикратно, а f – семикратно вырождены.
Граничные поверхности s -, p -, d -, f - орбиталей показаны на рис. 2.1.
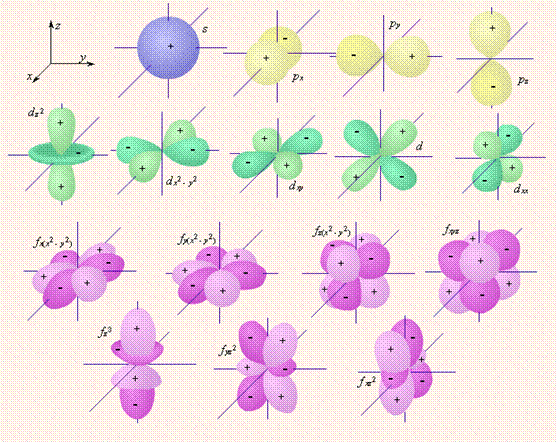
|
| Рисунок 2.1 Изображение с помощью граничных поверхностей s -, p -, d - и f -орбиталей. |
s -Орбитали сферически симметричны для любого n и отличаются друг от друга только размером сферы. Их максимально симметричная форма обусловлена тем, что при l = 0 и μ l = 0.
p -Орбитали существуют при n ≥ 2 и l = 1, поэтому возможны три варианта ориентации в пространстве: ml = –1, 0, +1. Все p -орбитали обладают узловой плоскостью, делящей орбиталь на две области, поэтому граничные поверхности имеют форму гантелей, ориентированных в пространстве под углом 90° друг относительно друга. Осями симметрии для них являются координатные оси, которые обозначаются px, py, pz.
d -Орбитали определяются квантовым числом l = 2 (n ≥ 3), при котором ml = –2, –1, 0, +1, +2, то есть характеризуются пятью вариантами ориентации в пространстве. d -Орбитали, ориентированные лопастями по осям координат, обозначаются dz ² и dx ²– y ², а ориентированные лопастями по биссектрисам координатных углов – dxy, dyz, dxz.
Семь f -орбиталей, соответствующих l = 3 (n ≥ 4), изображаются в виде граничных поверхностей, приведенных на рис. 2.1.
Квантовые числа n, l и ml не полностью характеризуют состояние электрона в атоме. Экспериментально установленно, что электрон имеет еще одно свойство – спин. Упрощенно спин можно представить как вращение электрона вокруг собственной оси. Спиновое квантовое числоms имеет только два значения ms = ±1/2, представляющие собой две проекции углового момента электрона на выделенную ось. Электроны с разными ms обозначаются стрелками, направленными вверх  и вниз
и вниз  .
.
В многоэлектронных атомах, как и в атоме водорода, состояние электрона определяется значениями тех же четырех квантовых чисел, однако в этом случае электрон находится не только в поле ядра, но и в поле других электронов. Поэтому энергия в многоэлектронных атомах определяется не только главным, но и орбитальным квантовым числом, а вернее их суммой: энергия атомных орбиталей возрастает по мере увеличения суммы n + l; при одинаковой сумме сначала заполняется уровень с меньшим n и большим l. Энергия атомных орбиталей возрастает согласно ряду
| 1 s < 2 s < 2 p < 3 s < 3 p < 4 s ≈ 3 d < 4 p < 5 s ≈ 4 d < 5 p < 6 s ≈ 4 f ≈ 5 d < 6 p < 7 s ≈ 5 f ≈ 6 d < 7 p. |
Итак, четыре квантовых числа описывают состояние электрона в атоме и характеризуют энергию электрона, его спин, форму электронного облака и его ориентацию в пространстве. При переходе атома из одного состояния в другое происходит перестройка электронного облака, то есть изменяются значения квантовых чисел, что сопровождается поглощением или испусканием атомом квантов энергии.
О. Штерн и В. Герлах, проводя прямые измерения магнитных моментов, обнаружили в 1922 г., что узкий пучок атомов водорода, заведомо находящихся в s -состоянии, в неоднородном магнитном поле расщепляется на два пучка. В этом состоянии момент импульса электрона равен нулю (см. (223.4)). Магнитный момент атома, связанный с орбитальным движением электрона, пропорционален механическому моменту (см. (131.3)), поэтому он равен нулю и магнитное поле не должно оказывать влияния на движение атомов водорода в основном состоянии, т. е. расщепления быть не должно. Однако в дальнейшем при применении спектральных приборов с большой разрешающей способностью было доказано, что спектральные линии атома водорода обнаруживают тонкую структуру (являются дублетами) даже в отсутствие магнитного поля.
Для объяснения тонкой структуры спектральных линий, а также ряда других трудностей в атомной физике американские физики Д. Уленбек (1900—1974) и С. Гаудсмит (1902—1979) предположили, что электрон обладает собственным неуничтожимым механическим моментом импульса, не связанным с движением электрона в пространстве, спином (см. §131).
Спин электрона (и всех других микрочастиц) — квантовая величина, у нее нет классического аналога; это внутреннее неотъемлемое свойство электрона, подобное его заряду и массе.
Если электрону приписывается собственный механический момент импульса (спин) L s, то ему соответствует собственный магнитный момент р ms. Согласно общим выводам квантовой механики, спин квантуется по закону
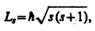
где s — спиновое квантовое число.
По аналогии с орбитальным моментом импульса, проекция Lsz спина квантуется так, что вектор L s может принимать 2 s +1 ориентации. Так как в опытах Штерна и Герлаха наблюдались только две ориентации, то 2 s +1=2, откуда s = ½. Проекция спина на направление внешнего магнитного поля, являясь квантованной величиной, определяется выражением, аналогичным (223.6):
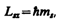
где тs — магнитное спиновое квантовое число; оно может иметь только два значения: ms = ± ½.
Таким образом, опытные данные привели к необходимости характеризовать электроны (и микрочастицы вообще) добавочной внутренней степенью свободы. Поэтому для полного описания состояния электрона в атоме необходимо наряду с главным, орбитальным и магнитным квантовыми числами задавать еще магнитное спиновое квантовое число.
Спин (от англ. spin — вертеть[-ся], вращение) — собственный момент импульса элементарных частиц, имеющий квантовую природу и не связанный с перемещением частицы как целого. Спином называют также собственный момент импульса атомного ядра или атома; в этом случае спин определяется как векторная сумма (вычисленная по правилам сложения моментов в квантовой механике) спинов элементарных частиц, образующих систему, и орбитальных моментов этих частиц, обусловленных их движением внутри системы.
Спин измеряется в единицах ħ (приведённой постоянной Планка, или постоянной Дирака) и равен 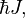 где J — характерное для каждого сорта частиц целое (в том числе нулевое) или полуцелое положительное число — так называемое спиновое квантовое число, которое обычно называют просто спином (одно из квантовых чисел).
где J — характерное для каждого сорта частиц целое (в том числе нулевое) или полуцелое положительное число — так называемое спиновое квантовое число, которое обычно называют просто спином (одно из квантовых чисел).
В связи с этим говорят о целом или полуцелом спине частицы.
Существование спина в системе тождественных взаимодействующих частиц является причиной нового квантовомеханического явления, не имеющего аналогии в классической механике: обменного взаимодействия.
Свойства спина
Любая частица может обладать двумя видами углового момента: орбитальным угловым моментом и спином.
В отличие от орбитального углового момента, который порождается движением частицы в пространстве, спин не связан с движением в пространстве. Спин — это внутренняя, исключительно квантовая характеристика, которую нельзя объяснить в рамках релятивистской механики. Если представлять частицу (например, электрон) как вращающийся шарик, а спин как момент, связанный с этим вращением, то оказывается, что поперечная скорость движения оболочки частицы должна быть выше скорости света, что недопустимо с позиции релятивизма.
Будучи одним из проявлений углового момента, спин в квантовой механике описывается векторным оператором спина 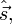 алгебра компонент которого полностью совпадает с алгеброй операторов орбитального углового момента
алгебра компонент которого полностью совпадает с алгеброй операторов орбитального углового момента 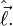 Однако, в отличие от орбитального углового момента, оператор спина не выражается через классические переменные, иными словами, это только квантовая величина. Следствием этого является тот факт, что спин (и его проекции на какую-либо ось) может принимать не только целые, но и полуцелые значения (в единицах постоянной Дирака ħ).
Однако, в отличие от орбитального углового момента, оператор спина не выражается через классические переменные, иными словами, это только квантовая величина. Следствием этого является тот факт, что спин (и его проекции на какую-либо ось) может принимать не только целые, но и полуцелые значения (в единицах постоянной Дирака ħ).
Date: 2015-05-17; view: 957; Нарушение авторских прав