
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Диаграммы состояния
|
|
Диаграммой состояния называют диаграмму, построенную в переменных р и Т и изображающую кривые равновесия при фазовых переходах данного вещества.
Рассмотрим тройную термодинамическую систему (лёд, вода и пар). Для такой системы существуют совершенно определённые значения давления р тр и температуры Т тр , при которых три фазы могут существовать одновременно.
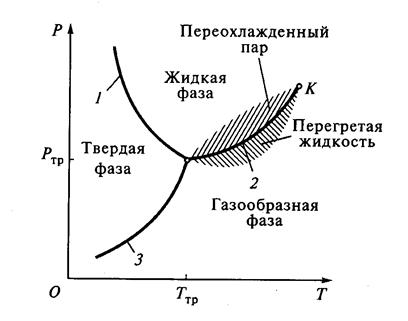
Точку на диаграмме состояния, соответствующую этим значениям давления и температуры, называют тройной. В этой точке встречаются кривая плавления 1, разделяющая твёрдую и жидкую фазы, кривая испарения 2, разделяющая жидкую и газообразную фазы, кривая возгонки 3, разделяющая твёрдую и газообразную фазы.
Точки, в которых могли бы одновременно существовать более трёх фаз, не реализуемы.
Для многих веществ характерны метастабильные состояния, при которых одна фаза существует в области температур и давлений другой фазы (переохлаждённый пар в области жидкой фазы и перегретая жидкость в области газообразной фазы).
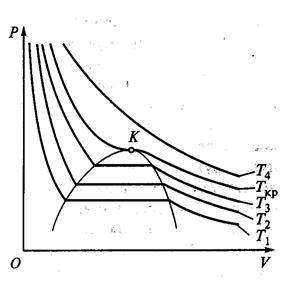 Если изобразить в р-V координатах изотерму двухфазной системы жидкость–газ то её горизонтальный участок будет соответствовать фазовому переходу вещества. Слева от него лежит изотерма газовой фазы, а слева – жидкой.
Если изобразить в р-V координатах изотерму двухфазной системы жидкость–газ то её горизонтальный участок будет соответствовать фазовому переходу вещества. Слева от него лежит изотерма газовой фазы, а слева – жидкой.
С повышением температуры плотность насыщенного пара возрастает и при некоторой температуре становится равной плотности жидкости. В точке К поверхностное натяжение обращается в нуль и исчезает различие между жидкой и газообразной фазами. Состояние, характеризуемое определённым набором значений температуры Т кр, давления р кр и объёма V кр называют критическим.
Date: 2015-05-09; view: 791; Нарушение авторских прав