
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Термодинамический процесс. Понятие термодинамического процесса характеризует термодинамическую систему с точки зрения ее энергетического взаимодействия с окружающей средой
|
|
Понятие термодинамического процесса характеризует термодинамическую систему с точки зрения ее энергетического взаимодействия с окружающей средой.
Термодинамическим процессомназывается процесс изменения состояния термодинамического тела (системы), не находящегося в термодинамическом равновесии с внешней средой и не изолированного от нее. При этом наблюдается энергетическое взаимодействие между телом и окружающей средой, сопровождающееся изменением параметров тела.
Строго говоря, только для процессов, происходящих очень медленно, с малыми отклонениями промежуточных параметров (квазистатические равновесные процессы), можно воспользоваться уравнениями состояния, а сам процесс геометрически представить в виде непрерывной кривой на термодинамической поверхности. Графическое изображение действительных неравновесных процессов, протекающих с конечной скоростью, имеет условный характер. Понятие равновесности характеризует поведение параметров внутри и на границах тел при процессах, но не затрагивает превращения форм энергии и распределения ее в системе. Для характеристики процессов с точки зрения превращения и распределения энергии между всеми телами, участвующими в процессе, вводится понятие обратимости процессов.
Обратимыми называются процессы, которые могут быть проведены в прямом и обратном направлениях таким образом, что все тела, участвующие в процессе, проходят через одни и те же промежуточные равновесные состояния (но в обратной последовательности), а после проведения прямого и обратного процессов все тела закрытой изолированной системы возвращаются в первоначальное состояние, и, следовательно, распределение энергии между ними оказывается прежним.
Процессы, не отвечающие поставленным условиям, называются необратимыми.
Все неравновесные процессы необратимы. Так, при неравенстве давления в рабочем теле и внешнего давления рабочее тело расширяется или сжимается, в результате возникают вихревые движения, которые со временем успокаиваются, а их энергия переходит в энергию теплового движения частиц. В этом случае наблюдается переход механической работы в теплоту, в результате чего для возврата системы в первоначальное состояние потребуется дополнительное количество механической работы.
При отсутствии термического равновесия процесс также необратим. Теплота самопроизвольно переходит от тела более нагретого к телу менее нагретому, и обратный переход теплоты возможен только при наличии дополнительного источника теплоты.
Необратимость процессов подразделяется:
- на внешнюю необратимость, вызванную разностью температур при теплообмене между телами;
- внутреннюю необратимость, вызванную наличием трения. В прямом и обратном процессах в этом случае имеется работа, затрачиваемая на трение, она превращается в теплоту.
Всякая необратимость связана с уменьшением возможной работы системы, эта потеря является мерой необратимости процесса. Процессы с полной потерей возможной работы называются предельно необратимыми. Примерами предельно необратимых процессов могут служить: расширение газа в вакуум, дросселирование газов и паров, рассеяние теплоты горячего тела в окружающую среду и т.п.
При термодинамических исследованиях процессов обычно не касаются внешней необратимости, обусловленной разностью температур при теплообмене, сами же процессы принимаются (естественно условно) внутренне равновесными. Такие процессы легко поддаются термодинамическому анализу, так как они могут изображаться графически в виде сплошных линий на диаграммах параметров состояния.
Пример обратимого и необратимого процессов с их графическим изображением в P,V- диаграмме приведен на рисунке 1.9.
Для обратимого процесса (рис. 1.9, а) сжатия газа в цилиндре с поршнем 1а2 характерно отсутствие трения (при этом под трением понимаем не только трение от взаимодействия поршня со стенками цилиндра, но и трение взаимодействия самого газа со стенками цилиндра и поршнем). На совершение процесса 1а2 затрачивается механическая работа L, соответствующая площади под процессом в P,V- диаграмме (в дальнейшем это будет доказано). Если дать возможность газу расшириться до первоначального состояния тоже по обратимому процессу 2а1, он повторит траекторию процесса 1а2 в обратной последовательности и вернется в первоначальное состояние 1. При этом механическая работа процесса расширения 2а1 будет численно равна механической работе сжатия процесса 1а2, но знак ее будет противоположный (-L). В результате осуществления прямого 1а2 и обратного 2а1 процессов суммарная внешняя механическая работа будет равна нулю: DL=0, т.е. распределение энергии в системе остается не
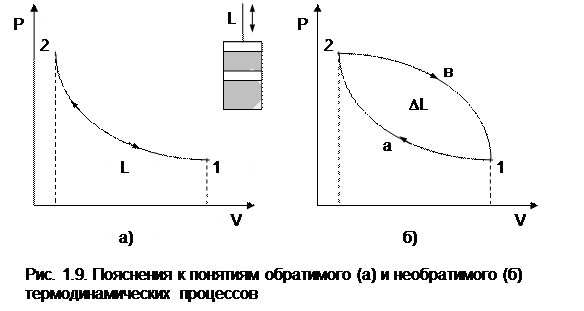 |
изменным, а процесс 1а2 по определению обратимый.
В необратимом процессе (рис. 1.9, б) сжатия газа в цилиндре 1а2 часть работы затратится на преодоление трения. Поэтому для возвращения газа в первоначальное состояние даже по обратимому процессу расширения работы сжатого газа будет недостаточно и потребуется дополнительная внешняя механическая работа. Следовательно, траектория обратного процесса 2в1 пройдет выше, чем у процесса 2а1. Разница работ этих процессов DL соответствует площади 1а2в1 в Р,V- диаграмме. Она отлична от нуля (DL>0), т.е. распределение энергии при возврате системы в первоначальное состояние изменилось, а процесс 1а2 по определению необратимый.
Все действительные процессы необратимы. В тех случаях, когда необратимость значительно изменяет характер процесса, это необходимо учитывать.
2. ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ ДЛЯ ЗАКРЫТОЙ СИСТЕМЫ
Первый закон термодинамики является одним из двух основных законов, на которых базируется вся современная термодинамика. Он получен на основании наблюдений и не имеет никакого другого доказательства, кроме человеческого опыта в земных условиях.
Открытие первого закона термодинамики относится к середине XIX века, а его основоположниками считают Р.Майера и Д.Джоуля [1].
Известно, что процесс изменения состояния термодинамического тела (системы) происходит при энергетическом взаимодействии его с внешней средой. Мерой этого взаимодействия является работа. Первый закон термодинамики представляет собой приложение к термодинамической системе общего закона сохранения энергии, согласно которому в замкнутой изолированной системе возможны взаимопревращения форм энергии, но сумма всех видов энергии является величиной постоянной. Аналитическое выражение этой формулировки будет соответствовать равенству энергии такой термодинамической системы в начале и конце процесса:
ΔE=0 или Е=const, (2.1)
где Е – энергия термодинамической системы.
Для неизолированной термодинамической системы изменению энергии будет соответствовать сумма работ, произведенных в этой системе, поскольку работа есть мера энергетического взаимодействия. Для такой системы закон сохранения энергии будет представлен выражением
ΔЕ = А1 + А2 + А3 + ··· + Аn, (2.2)
где А1 … Аn – работы данной термодинамической системы.
Для получения выражения первого закона термодинамики необходимо установить взаимосвязь различных форм преобразования энергии с полученными в результате этих преобразований работами в теле или системе.
В данном разделе познакомимся с первым законом термодинамики для закрытых (без обмена веществом с окружающей средой) термодинамических систем. Для открытых систем первый закон термодинамики будет рассмотрен позднее, по мере необходимости изучения соответствующих процессов: истечения, дросселирования, смешения и т.п.
Для строгого математического формулирования этого закона необходимо дать понятия возможных форм энергии и работ, применительно к термодинамической системе.
Date: 2015-05-09; view: 1308; Нарушение авторских прав