
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Свойства реальных газов
|
|
Реальные газы отличаются от идеальных газов тем, что молекулы этих газов имеют конечные собственные объемы и связаны между собой силами взаимодействия, имеющими электромагнитную и квантовую природу. Эти силы существуют между любыми молекулами при любых условиях и уменьшаются с увеличением расстояния между молекулами. При сближении молекул на малые расстояния силы притяжения резко уменьшаются и переходят в силы отталкивания, достигающие очень больших значений. В связи с этим законы идеальных газов ни при каких условиях не могут быть строго применимы к реальным газам.
При практических расчетах различных свойств реальных газов находит широкое применение отношение 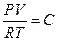 , которое получило название коэффициента сжимаемости.
, которое получило название коэффициента сжимаемости.
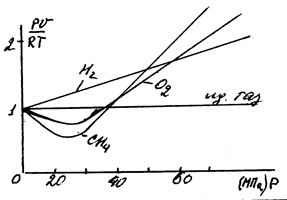
Рисунок 9 – Зависимость коэффициента С от давления
Для реальных газов 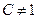 и в зависимости от давления и температуры может быть больше и меньше 1, и только при очень малых давлениях и высоких температурах оно практически равно 1. Таким образом, свойства реальных газов как в количественном, так и качественном отношениях значительно отличаются от свойств идеальных газов. Поэтому все результаты, полученные для реальных газов на основе законов идеальных газов, нужно рассматривать как приближенные и справедливые при очень больших разрежениях (
и в зависимости от давления и температуры может быть больше и меньше 1, и только при очень малых давлениях и высоких температурах оно практически равно 1. Таким образом, свойства реальных газов как в количественном, так и качественном отношениях значительно отличаются от свойств идеальных газов. Поэтому все результаты, полученные для реальных газов на основе законов идеальных газов, нужно рассматривать как приближенные и справедливые при очень больших разрежениях (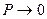 ).
).
Отличие свойств любого реального газа от свойств идеального заставило ученых разрабатывать новые уравнения состояния, которые связывали бы значения Р, V, Т и давали бы возможность рассчитывать некоторые свойства газов для разных условий, не прибегая к сложным и дорогостоящим измерениям.
За последние 100 лет было предложено значительное число различных уравнений состояния реальных газов, но ни одно из них не решает проблему для общего случая.
29 Развитие кинетической теории газов позволило установить точное уравнение (Боголюбова-Майера) состояния реальных газов в таком виде:
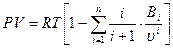 . (104)
. (104)
В этом уравнений коэффициенты 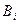 в правой части уравнения называются вириальными коэффициентами и выражаются через потенциальную энергию взаимодействия молекул данного газа и температуру, а
в правой части уравнения называются вириальными коэффициентами и выражаются через потенциальную энергию взаимодействия молекул данного газа и температуру, а 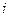 =2, 3, 4... – порядковый номер вириального коэффициента.
=2, 3, 4... – порядковый номер вириального коэффициента.
Однако, полученное уравнение в общем виде не может быть использовано для непосредственных расчетов реальных газов из-за сложности вычисления вириальных коэффициентов.
30 Наиболее простым и качественно верно отражающим поведение реального газа является уравнение Ван-дер-Ваальса, которое получается как частный случай из общего уравнения состояния Боголюбова-Майера (104).
Если пренебречь в правой части уравнения (104) всеми 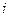 -тыми членами, содержащими
-тыми членами, содержащими 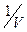 во 2-ой, 3-ей и т.д. степени, что допустимо, если плотность газа невелика, то получим уравнение Ван-дер-Ваальса, которое было опубликована в 1873 г.:
во 2-ой, 3-ей и т.д. степени, что допустимо, если плотность газа невелика, то получим уравнение Ван-дер-Ваальса, которое было опубликована в 1873 г.:

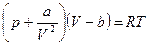 , (105)
, (105)
где 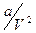 – поправка на внутреннее давление, определяемое взаимным притяжением молекул газа, для жидкостей оно принимает очень большие значения (например, для H2O при температуре 293 К
– поправка на внутреннее давление, определяемое взаимным притяжением молекул газа, для жидкостей оно принимает очень большие значения (например, для H2O при температуре 293 К 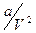
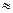 1080 МПа, для газов внутреннее давление сравнительно невелико и зависит от Р и Т газа.
1080 МПа, для газов внутреннее давление сравнительно невелико и зависит от Р и Т газа.
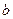 – поправка на объем самих молекул, т.е. это тот наименьший объем, до которого можно сжать газ.
– поправка на объем самих молекул, т.е. это тот наименьший объем, до которого можно сжать газ.
Уравнение Ван-дер-Ваальса (105) при больших плотностях газа дает значительные ошибки, т.к. при его выводе не учитывались некоторые добавочные физические явления, прежде всего так называемые: силовая ассоциация и диссоциация молекул. Кроме того, опытами установлено, что коэффициенты 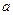 и
и 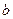 не могут быть постоянными, а должны зависеть от температуры и давления, причем зависимость очень сложная.
не могут быть постоянными, а должны зависеть от температуры и давления, причем зависимость очень сложная.
31 Советские ученые Вукалович М.П. и Новиков И.И. в 1939 г. предложили новое универсальное уравнение состояния реальных газов, качественно отличное от уравнения Ван-дер-Ваальса. При выводе своего уравнения авторы учли указанное выше явление силовой ассоциации молекул под влиянием межмолекулярных сил взаимодействия.
В наиболее простой форме, когда учитываются лишь двойные комплексы, уравнение Вукаловича – Новикова имеет следующий вид:
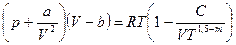 , (106)
, (106)
где а и b – постоянные уравнения Ван-дер-Ваальса;
С и m - постоянные, определяемые на основании опытных данных.
Полученное Уравнение состояния было взято за основу при создании первых таблиц воды и водяного пара, выпущенных М.П. Вукаловичем в 1940 г.
Date: 2015-05-09; view: 1500; Нарушение авторских прав