
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Идеальные газы и их смеси
|
|
Идеальными газами (ИГ) называют такие, которые полностью подчиняются законам Бойля-Мариотта и Гей-Люссака. В ИГ отсутствуют силы взаимного притяжения и отталкивания между молекулами, а объем самих молекул пренебрежимо мал по сравнению с объемом газа. Состояние ИГ – это предельное состояние реального газа, когда давление стремится к нулю (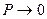 ).
).
Введение понятия об идеальном газе позволило составить простые математические зависимости между величинами, характеризующими состояние тела, и на основе законов для ИГ создать стройную теорию ТДП.
Закон Бойля – Мариотта (английский физик 1664 г. – французский химик 1676 г.) гласит: при постоянной температуре объем, занимаемый ИГ, изменяется обратно пропорционально его давлению:
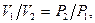 (10)
(10)
или при постоянной температуре 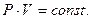
Закон Гей-Люссака (французский физик 1803 г.) устанавливает зависимость между удельным объемом 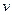 и абсолютной температурой T. Закон гласит: при постоянном давлении объемы одного и того же количества ИГ изменяются прямо пропорционально абсолютным температурам:
и абсолютной температурой T. Закон гласит: при постоянном давлении объемы одного и того же количества ИГ изменяются прямо пропорционально абсолютным температурам:
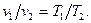 (11)
(11)
Совместное применение этих законов к произвольному процессу дает уравнение состояния ИГ:
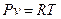 . (12)
. (12)
При умножении обеих частей уравнения (12) на массу газа (М, кг) получаем:
PV=MRT (13)
где R – удельная газовая постоянная, 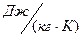 .
.
Уравнения (12) и (13) называются уравнениями Клапейрона. С достаточной для практики точностью их можно применять и для реальных газов, имеющих низкое давление и высокую температуру.
Умножив обе части уравнения (13) на молярную массу газа (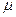 ,
, 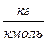 ) получим уравнение Клапейрона – Менделеева:
) получим уравнение Клапейрона – Менделеева:
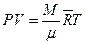 . (14)
. (14)
Величина 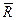 носит название универсальной газовой постоянной:
носит название универсальной газовой постоянной:
 .
.
Date: 2015-05-09; view: 885; Нарушение авторских прав