
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Глава 11. Электрохимия. Гальванические элементы
|
|
После изучения этой главы вы должны знать:
- механизм возникновения двойного электрического слоя на границе раздела фаз;
- химические источники тока: гальванические элементы и аккумуляторы;
- устройство стандартного водородного электрода и измерение с его помощью потенциалов электродов;
- стандартные и нормальные (равновесные) потенциалы, ряд стандартных электродных потенциалов, уравнения Нернста, расчет ЭДС гальванических элементов.
При погружении металлической пластинки в раствор соли этого же металла на поверхности металла образуется двойной электрический слой:
а) если металл активный или средней активности (Zn, Fe, Sn и др.), то часть его атомов переходит в ионы, металлическая пластинка заряжается отрицательно, катионы Ме притягиваются к ней (рис. 14а);
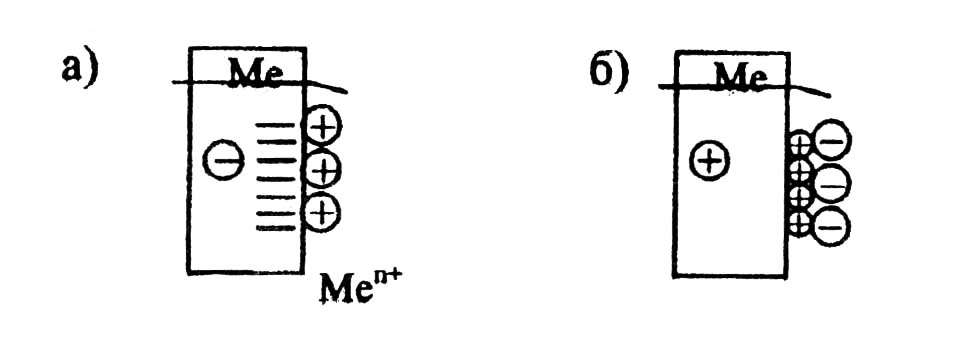
б) если металл малоактивен (слабый восстановитель), то его катионы из раствора - сильные окислители - забирают электроны металлической пластинки и оседают на ее поверхности. Пластина, при этом, заряжается положительно и притягивает к себе анионы из раствора (рис. 14б).
Рис. 14. Образование двойного слоя и электродного потенциала на границе металл /раствор
Разница потенциалов, возникающая в двойном электрическом слое на границе металл /раствор, называется электродным потенциалом. Измерить потенциал отдельного электрода невозможно, поэтому для измерения потенциалов используют гальванические элементы.
Для измерения стандартных потенциалов металлическую пластинку, погруженную в раствор собственной соли с концентрацией ионов металла 1моль/л, соединяют со стандартным водородным электродом. Стандартный водородный электрод представляет собой платиновую пластинку, насыщенную газообразным водородом и погруженную в 1 М раствор HCl при t=250 C, P=1 атм. Потенциал стандартного водородного электрода условно равен нулю. Разность потенциалов между металлом и стандартным водородным электродом называется стандартным электродным потенциалом (Е0). Металлы, расположенные в порядке возрастания Е0, составляют электрохимический ряд напряжений металлов (ряд стандартных электродных потенциалов).
Этот ряд характеризует окислительную способность катионов металлов и восстановительную способность атомов металлов. Электродный потенциал зависит от природы металла, концентрации его катионов в растворе, температуры.
При непосредственном контакте двух металлов в растворе электролита образуется гальванический элемент – прибор, в котором энергия химической реакции окисления-восстановления превращается в электрическую (рис 15). Гальванические элементы используются как химические источники электроэнергии.
Рис. 15. Медно-цинковый гальванический элемент
Схематически гальванический элемент изображается так:
(анод) Zn / ZnSO4 // CuSO4 / Cu (катод)
Анод – более активный металл (с меньшим электродным потенциалом) будет отдавать свои электроны менее активному металлу:
Zn0 - 2e ® Zn2+
восстановитель
Катод – менее активный металл(с большим электродным потенциалом), на поверхности которого идет восстановление окисленных ионов из раствора:
Cu+2 + 2e ® Cu0
окислитель
Суммарное уравнение: Zn + CuSO4 = Cu + ZnSO4
Гальванический ключ необходим для сохранения поляризации электродов (разности потенциалов). По нему производят отвод избыточного заряда, накапливаемого в процессе работы гальванического элемента.
Стандартную ЭДС гальванического элемента можно вычислить по разности стандартных электродных потенциалов окислителя и восстановителя:
ЭДС0 = Е0 ок-ля – Е0 вос-ля = Е0 cu2+/cu – E0 zn2+/zn = 0,34-(-0,76) = 1,1 В
Если реакция идет не в стандартных условиях, то электродные потенциалы металлов рассчитываются по формуле Нернста:
Е Ме+n/ Ме = Е0Ме+n/ Ме + 0,059/n lgCМеn+, при t =25 0C
ЕМе+n/ Ме – электродный потенциал металла; Е0 Ме+n/ Ме – стандартный электродный потенциал металла; С Меn+ – концентрация ионов металла в моль/л; n- число переданных электронов.
Date: 2015-05-09; view: 915; Нарушение авторских прав