
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Приближенные значения перенапряжения водорода и кислорода на различных материалах
|
|
| Мат-л | Pt | Fe | Ni | Cu | Pb | Zn | Al | Cd | Hg | Cгр |
| DjН2,B | 0,09 | 0,08 | 0,21 | 0,40 | 0,64 | 0,70 | 0,70 | 0,80 | 0,94 | 0,65 |
| DjО2, B | 0,45 | 0,25 | 0,06 | - | 0,31 | - | - | - | - | - |
Примечание: в местах «-» научные данные отсутствуют (в этих случаях в расчетах Dj не учитывать).
При наличии нескольких видов ионов или недиссоциированных электрохимически активных веществ возможно протекание нескольких электродных реакций. Так на катоде идет реакция восстановления, т.е. прием электронов окислителем, то в первую очередь должны реагировать наиболее сильные окислители. Следовательно протекает реакция с более положительным потенциалом. Поэтому для катодного восстановления можно предложить следующий порядок разрядки катионов:
1. В первую очередь на катоде разряжаются катионы металлов, стоящих в ряду напряжений металлов после водорода (высокий положительный окислительный потенциал).
2. Во вторую очередь в кислой среде разряжаются катионы водорода: 2Н+ + 2е ® Н2,
Ен+/н2 = Е0н+/н2 + 0,059 lg CH+ или Ен+/н2 = Е0н+/н2 – 0,059рН
Например при рН = 1 Ен+/н2 = -0,059 В, а следовательно ионы металлов, имеющие более низкие потенциалы, (см. ряд напряжений) разряжаться (восстанавливаться) не будут.
3. Одновременно с водой (разряд атома водорода) могут разряжаться катионы металлов, стоящих в ряду напряжений от алюминия до водорода (1,66 В < Е0 < 0 В).
Разряд воды на катоде: 2Н+2О +2е ® Н02 + 2ОН-
Потенциал данной реакции можно рассчитать по уравнению Нернста: Ен+/н2 = Е0н+/н2 – 0,059рН, Ен+/н2 (при рН =7)= -0,41В и при условии Рн2 = 1Ат (давление), Т = 298 К,
Почему возможно выделение таких металлов как Zn (Е0Zn/Zn2+ = -0,76 В), Cr (Е0Cr/Cr3+= -0,71В) из растворов их солей? Это объясняется перенапряжением (затруднением) выделения водорода, т.е. при пропускании тока потенциал выделения водорода уменьшается (сдвиг потенциала в область отрицательных значений). Таким образом, достигается такое состояние, когда потенциал восстановления катиона металла и реальный потенциал разряда воды соизмеримы.
4. В растворах никогда не разряжаются катионы металлов, стоящих в ряду напряжений металлов до алюминия (включительно), так как имеют очень низкие электродные потенциалы. В этих случаях на катоде происходит только разряд воды 2Н+2О + 2е ® Н02 + 2ОН- (в нейтральной и щелочной средах).
На аноде протекают реакции окисления восстановителей, т.е. отдача электронов восстановителем, поэтому в первую очередь на аноде должны реагировать наиболее сильные восстановители – вещества, имеющие наиболее низкий потенциал.
Анодный процесс зависит от вещества, из которого сделан анод. Аноды подразделяют на нерастворимые: графит, платина, золото или некоторые пассивные металлы, например, нержавеющая сталь и растворимые: медь, серебро, цинк, никель и другие металлы. В случае электролиза с растворимым анодом окисляется сам анод. При электролизе растворов на инертных анодах разрядка анионов или молекул воды идет в определенном порядке:
1. В первую очередь разряжаются бескислородные ионы:
S-2 (Е0 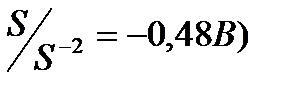 , J- (Е0
, J- (Е0 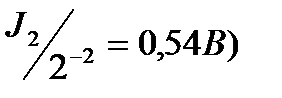 , Br- (E0
, Br- (E0 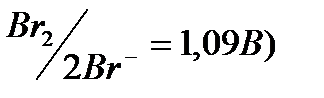 , Cl- (E0
, Cl- (E0 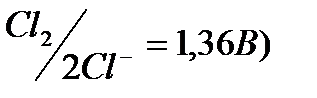 , хотя потенциал окисления атома кислорода в Н2О (Ео2/2о-2 = 0,82 В, рН = 7) ниже, чем для некоторых выше перечисленных ионов (Cl-, Br-). Oднако, в связи с перенапряжением выделения кислорода ( потенциал процесса сдвигается в область более высоких значений ), при пропускании тока легче окисляются бескислородные ионы.
, хотя потенциал окисления атома кислорода в Н2О (Ео2/2о-2 = 0,82 В, рН = 7) ниже, чем для некоторых выше перечисленных ионов (Cl-, Br-). Oднако, в связи с перенапряжением выделения кислорода ( потенциал процесса сдвигается в область более высоких значений ), при пропускании тока легче окисляются бескислородные ионы.
2. Во вторую очередь разряжается гидроксид-ион (шелочная среда рН >7): 4 О-2 Н- -4е ® О02 + 2Н2О (Ео2/2о-2 = 0,4В при рН=14)
3. Разряд атома кислорода в воде:
| 2Н2О-2 ®О02 +4Н+ | Ео2/2о-2 = 0,82 В, рН = 7 – нейтральная среда |
| Ео2/2о-2=1,23 В, pH = 0 – кислая среда |
Указанные потенциалы разряда кислорода (пункты 2, 3) рассчитывают по уравнению Нернста: Ео2/2о-2 = 1,23 – 0,059рН, при условии р2 = 1Ат, Т =298 К.
4. В растворе не разряжаются анионы кислородсодержащих кислотных остатков и F-.
Date: 2015-05-09; view: 826; Нарушение авторских прав