
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Уравнение состояния. Для равновесной термодинамической системы существует функциональная связь между параметрами состояния
|
|
Для равновесной термодинамической системы существует функциональная связь между параметрами состояния, которая называется уравнением состояния. Опыт показывает, что удельный объем, температура и давление простейших систем, которыми являются газы, пары или жидкости, связаны термическим уравнением состояния вида 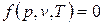 .
.
Уравнению состояния можно придать другую форму: 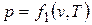 ,
, 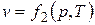 ,
, 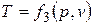 . Эти уравнения показывают, что из трех основных параметров, определяющих состояние системы, независимыми являются два любых.
. Эти уравнения показывают, что из трех основных параметров, определяющих состояние системы, независимыми являются два любых.
Конкретный вид уравнения состояния зависит от индивидуальных свойств вещества.
Уравнение состояния идеальных газов. Как известно, им является уравнение Клапейрона (1834 г.)
 , (1.3)
, (1.3)
где V – объем, занимаемый массой М идеального газа. Величину R, Дж/(кг×К), называют удельной газовой постоянной (т.е. отнесенной на 1 кг газа). Поделив левую и правую части уравнения (1.3) на М, получим
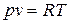 . (1.4)
. (1.4)
Уравнению Клапейрона можно придать универсальную форму, если отнести газовую постоянную к 1 кмолю газа, т. е. к количеству газа, масса которого в килограммах численно равна молекулярной массе m. Положив в (1.3) М = m и V = V m, получим для одного моля уравнение Клапейрона – Менделеева:
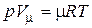 . (1.5)
. (1.5)
здесь m R – универсальная газовая постоянная.
В соответствии с законом Авогадро (1811 г.) объем 1 кмоля, одинаковый в одних и тех же условиях для всех идеальных газов, при нормальных физических условиях равен 22,4136 м3,
m R = pV m/ T = 101,325 × 22,4136 / 273,15 = 8,314 кДж/(кмоль×К). (1.6)
Удельная газовая постоянная составляет R = 8,314/m, кДж/(кг×К).
Date: 2015-05-09; view: 767; Нарушение авторских прав