
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Опыт 3. Образование хлорида аммония
|
|
В основе опыта лежит следующая химическая реакция:
NH3(г) + HCl(г) = NH4Cl(к).
Реактивы: концентрированный раствор аммиака, концентриро-ванная соляная кислота.
Посуда и принадлежности: широкий стакан емкостью 500-1000 мл, два фарфоровых тигля, стеклянная или керамическая пластинка.
Методика проведения опыта. Внесите в один тигель несколько капель соляной кислоты и поставьте его на пластинку. Во второй тигель налейте несколько капель раствора аммиака и поставьте рядом на пластинку. Закройте тигли одним стаканом. Наблюдайте за процессом появления соли и отразите это в лабораторном журнале. Запишите наблюдения. Рассчитайте значения изменения энтальпии, энтропии и энергии Гиббса реакции, используя данные таблицы 1.4.
В выводе объясните, почему данная реакция протекает самопроизвольно, подтвердив ответ термодинамическими расчетами.
Опыт 4. Определение характера тепловых эффектов растворения солей (УИРС)
При растворении кристаллических солей в воде происходит разру-шение их кристаллических решеток, которое сопровождается поглощением теплоты (DHР>0), и образование гидратированных ионов, приводящее к выделению теплоты гидратации (DHгидр<0). Если растворяемая соль не подвергается гидролизу, то общая теплота растворения соли складывается из этих составляющих: ∑ΔНобщ = DHР + + DHгидр. В зависимости от значения ∑ΔНобщ растворение протекает с разогреванием (экзотермичный процесс) или охлаждением (эндотермичный процесс).
В этом опыте следует сравнить тепловые эффекты, которые сопровождают растворение безводного сульфата натрия Na2SO4 и его кристаллогидрата Na2SO4·10H2O, установить термохимический тип процесса растворения солей и знаки изменения энтальпии, а также рассчитать теплоту гидратации сульфата натрия. Теплота гидратации соли определяется по разности теплот растворения безводной соли и ее кристаллогидрата. Значения тепловых эффектов процессов растворения известны:
Н2О, растворение
Na2SO4(K) → Na2SO4(Р) + 80,33 кДж.
Н2О, растворение
Na2 SO4·10H2O(K) → Na2SO4(Р) – 78,66 кДж.
Реакция образования кристаллогидрата при растворении безводной соли:
Na2SO4(K) + 10H2O(Ж) = Na2SO4·10H2O(K) + QГИДР, кДж.
Реактивы: кристаллический безводный сульфат натрия Na2SO4, кристаллогидрат Na2SO4·10H2O, дистиллированная вода.
Посуда и принадлежности: два стакана емкостью 300-400 мл, мерный цилиндр, термометр, шпатель.
Методика проведения опыта. В стакан налейте 50-100 мл воды, погрузите в нее термометр и внесите несколько шпателей безводной соли. Отметьте, идет ли растворение соли, выделяется ли теплота. Налейте воду в другой стакан, опустите в нее термометр и внесите примерно столько же кристаллогидрата Na2SO4·10H2O. Отметьте, с каким тепловым эффектом происходит его растворение. Укажите, процесс растворения какой соли экзотермичен, а какой – эндотермичен. Рассчитайте теплоту гидратации при образовании кристаллогидрата Na2SO4·10H2O из безводной соли, используя приведенные термохимические уравнения.
В выводах:
– укажите термохимические типы процессов растворения безводной соли и ее кристаллогидрата;
– объясните, почему: а) образование кристаллогидрата происходит самопроизвольно; б) при упаривании многих солевых растворов соли выделяются в виде кристаллогидратов, для разложения которых требуется нагревание.
Таблица 1.4 – Термодинамические константы веществ
| Вещество | ΔНо298, кДж/моль | ΔGo298 кДж/моль | So298 Дж/моль∙К |
| Сr2O3(к) | -1440,6 | -1050,0 | 81,2 |
| (NH4)2Сr2O7(к) | -1799,0 | – | – |
| H2O (г) | -241,8 | -228,6 | 188,7 |
| H2O (ж) | -285,8 | -237,3 | 70,1 |
| N2 (г) | 191,5 | ||
| NH3 (г) | -46,2 | -16,6 | 192,6 |
| NH4Cl (к) | -315,4 | -343,6 | 94,6 |
| HCl (г) | -92,3 | -95,3 | 186,8 |
| HCl (ж) | -167,5 | -131,2 | 55,2 |
Продолжение таблицы 1.4 – Термодинамические константы веществ
| Na2SO4(к) | -1388,0 | -1270,2 | 149,7 |
| Na2SO4·10H2O(K) | -4327,6 | -3645,3 | 592,3 |
| NaOH(Р) | -470,4 | -48,1 | 422,4 |
| КОН(Р) | -482,7 | -91,7 | 440,9 |
| HCl(Р) | -167,1 | -56,5 | 131,3 |
| HNO3(Р) | -207,4 | -147,2 | 111,6 |
| NaNO3(Р) | -448,0 | -206,2 | 373,8 |
| КСl(Р) | -419,3 | -157,4 | 413,8 |
Тема 2. Скорость химических реакций и методы ее регулирования (базовый материал)
Рекомендуемая литература по теме 2 приведена на с. 17.
Скорость химических реакций отражает число актов химического взаимодействия, происходящих в единице объема (для гомогенных реакций) или на единице площади поверхности раздела фаз (для гетерогенных реакций) в единицу времени.
Средняя скорость химического процесса выражается изменением концентрации (ΔС) веществ – реагентов или продуктов реакции в единицу времени.
Полная последовательность всех элементарных стадий в процессе взаимодействия отражает механизм химических реакций.
Число частиц, участвующих в каждом элементарном химическом акте, показывает молекулярность реакции.
Главные факторы, влияющие на скорость реакции: природа реагентов, их агрегатное состояние, концентрация реагентов, давление (для реакций с участием газов), температура, специальные факторы (катализ, инициирование, ингибирование), площадь раздела фаз (для гетерогенных реакций).
Влияние концентрации. Химическое взаимодействие веществ происходит лишь при активном столкновении их молекул, поэтому, чем больше концентрация реагирующих веществ, тем выше вероятность активных столкновений и, следовательно, скорость реакции. Зависимость скорости реакции от концентрации выражается законом действия масс:
Скорость гомогенной химической реакции при данной температуре прямо пропорциональна произведению концентраций реагирующих веществ или парциальных давлений газообразных веществ, взятых в степенях, равных их стехиометрическим коэффициентам.
Для гомогенной реакции общего вида аА + bВ = сС (А и В – реагенты, С – продукт реакции, а, b и с – стехиометрические коэффициенты), протекающей в истинных растворах, выражение ее скорости описывается уравнением:
V = k· [A]а·[B]b или V = k · CaA · CbB, моль/л·с,
где [A], [B] или CA, CB – молярные концентрации веществ А и В, (моль/л); k – коэффициент пропорциональности, называемый константой скорости.
Для этой же реакции, протекающей в газовой фазе, скорость реакции будет выражена уравнением:
V = k · РaA · РbB, моль/л·с,
где РaA и РbB – парциальные давления веществ А и В.
Константа скорости – это скорость реакции при концентрациях реагирующих веществ, равных единице. Константа скорости зависит от химической природы веществ, температуры и специального фактора (присутствия катализатора, инициатора или ингибитора), но не зависит от концентрации реагирующих веществ или создаваемого ими парциального давления (в газовых реакциях).
Скорость гетерогенной реакции не зависит от концентрации твердого вещества, потому что такая реакция проходит только на поверхности раздела фаз. Например, при одинаковой степени измельчения поверхность раздела будет постоянной и уравнение скорости гетеро-генной реакции СО2(Г) + С(К) = 2СО(Г) записывается так:
V = k · [СО2].
Влияние температуры. Экспериментально установлено, что в некотором интервале температур скорость реакции при повышении температуры на каждые 10о увеличивается в число раз, равное температурному коэффициенту γ (правило Вант-Гоффа), т. е.
VT2 = VT1 · γ 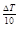 ,
,
где VT2 и VT1 – скорости реакции при температурах Т1 и Т2; ΔT – изменение температуры, равное Т2–Т1; γ – температурный коэффициент реакции, в большинстве случаев имеющий значения от 2 до 4.
Температурный коэффициент γ показывает, во сколько раз изменится скорость реакции при изменении температуры на 10 оС: γ = VT2/VT1 при ΔT = 10.
Влияние температуры на скорость реакции весьма существенно. Химическое взаимодействие происходит при столкновении только тех молекул, энергия которых выше энергии активации (Еакт).
Энергия активации (кДж/моль) – количество энергии, которое необходимо приложить к 1 молю вещества, чтобы произошло превращение исходных веществ в продукты реакции. Иначе говоря, энергия активации – это разность между наименьшим избыточным запасом энергии, необходимым для взаимодействия молекул, и их среднестатистическим запасом энергии.
Энергия активации связана с константой скорости реакции уравнением Аррениуса:
K = A · e 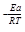 ,
,
где А – предэкспоненциальный множитель, учитывающий строение вещества; R – универсальная газовая постоянная, равная 8,314 Дж/моль . К; Т – абсолютная температура, К; Еакт – энергия активации процесса, Дж/моль; е – основание натурального логарифма.
Влияние катализатора. Катализаторы – это вещества, которые резко изменяют скорость термодинамически возможной химической реакции, участвуют в ней на промежуточных стадиях, но в конце реакции остаются химически неизменными. Катализ – явление изменения скорости реакции при внесении катализатора. По фазовому состоянию реагентов и катализатора различают гомогенный катализ, при котором они находятся в одной и той же фазе, и гетерогенный катализ, при котором катализатор образует самостоятельную фазу.
По действию различают положительные катализаторы, которые увеличивают скорость реакции, и отрицательные катализаторы, уменьшающие ее.
Положительные катализаторы снижают величину энергии активации процесса. Так, в реакции СН3СНО → СН4 + СО без участия катализатора энергия активации составляет 216,7 кДж/моль, тогда как в присутствии паров иода (катализатор) Еакт = 143,0 кДж/моль. Отрицательные катализаторы повышают энергию активации всей реакции.
Рекомендуемая литература по теме 2:[1], гл. 6, 6.2; [2], гл. 7; [5], гл. V.
Лабораторная работа № 2.1 Влияние различных факторов на скорость реакций (с элементами УИРС)
Цель работы: изучение факторов, влияющих на скорость химических реакций – концентрации веществ, температуры, катализа, величины и состояния поверхности реагирующих веществ в гетерогенной системе.
Date: 2015-05-08; view: 1267; Нарушение авторских прав