
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Процесс водяного парообразования
|
|
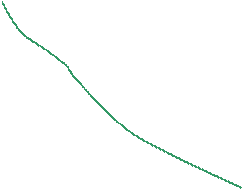
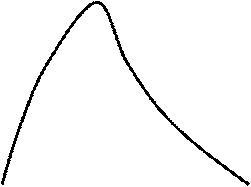
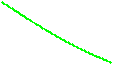
Фазовая p-v диаграмма (рис. 4.1) системы, состоящей из жидкости и пара, представляя собой график зависимости удельных объёмов воды и пара от давления, делится нижней пограничной кривой BK и верхней пограничной кривой KC на три области. Влево от кривой BK до нулевой изотермы воды (линия AE) располагается область жидкости. Вправо от кривой KC и вверх от точки K располагается область перегретого пара. В области, ограниченной нижней и верхней пограничными кривыми, располагается двухфазная система, состоящий из смеси воды и пара (влажный пар). Обе кривые сливаются в одной точке K, которая называется критической точкой.
В критической точке исчезает различие между жидкостью и паром. Выше критической точки двухфазное состояние системы невозможно.
Линия AE представляет собой точки, в которых вода имеет температуру 0 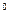 С при различных давления. Область графика, заключённая между изотермой воды при температуре 0
С при различных давления. Область графика, заключённая между изотермой воды при температуре 0 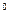 С (линия AE) и осью p, представляет собой среду равновесного существования жидкой и твёрдой фаз воды.
С (линия AE) и осью p, представляет собой среду равновесного существования жидкой и твёрдой фаз воды.
Линия BK – это место точек, характеризующих воду в состоянии кипения при разных давлениях.
Линия KC показывает зависимость удельного объёма сухого насыщенного пара от давления.
В технике (в паровых котлах) пар из воды образуется при постоянном давлении, поэтому термодинамическую сторону процесса парообразования можно рассмотреть так же при постоянном давлении: p = const.
Если рассмотреть процесс образования перегретого пара при давлении p 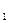 (см. рис. 4.1), то можно выделить три последовательно осуществляемых физических процесса:
(см. рис. 4.1), то можно выделить три последовательно осуществляемых физических процесса:
1. Подогрев жидкости от температуры 0 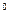 С до температуры кипения
С до температуры кипения
(температуры насыщения) T 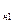 – отрезок a
– отрезок a 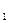 b
b 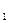 .
.
2. Парообразование при постоянной температуре T 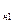 – отрезок b
– отрезок b 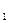 с
с 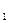 .
.
3. Перегрев пара (нагревание пара от температуры T 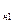 до T
до T 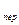 ) – отрезок с
) – отрезок с 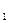 d
d 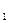 .
.
Количество теплоты, необходимое для превращения в сухой насыщенный пар (точка с 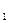 ) 1 кг воды, нагретой до температуры насыщения при заданном давлении p
) 1 кг воды, нагретой до температуры насыщения при заданном давлении p 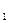 (точка b
(точка b 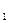 ), называется скрытой теплотой парообразования и обозначается буквой r. Вся энергия, подводимая в виде теплоты к пару в этом процессе, расходуется на преодоление сил сцепления между молекулами (работу дисгрегации) и расширение пара, поэтому при постоянном давлении температура влажного пара остаётся также постоянной.
), называется скрытой теплотой парообразования и обозначается буквой r. Вся энергия, подводимая в виде теплоты к пару в этом процессе, расходуется на преодоление сил сцепления между молекулами (работу дисгрегации) и расширение пара, поэтому при постоянном давлении температура влажного пара остаётся также постоянной.
p

 T
T 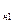 T
T 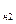 T
T 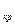 T
T 

 E
E

 p
p  K
K





 p
p  d
d 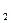
a 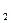 b
b 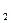 c
c 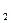





 p
p 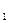 a
a 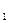 b
b 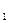 c
c 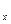 c
c 


 d
d 
 2 T
2 T 
 A B C T
A B C T 

 x = const
x = const
0 v
v 
 v
v 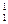

 v
v 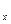
 v
v 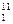
v 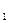

Рис. 4.1. Диаграмма состояния водяного пара
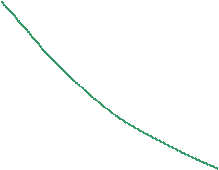
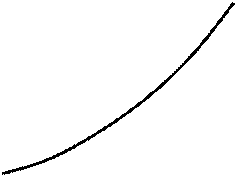
Из p-v диаграммы видно, что каждому давлению соответствует своя температура насыщения (линия KC). Характер зависимости между давлением насыщенного пара p 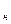 и температурой насыщения T
и температурой насыщения T 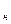 (кривая насыщения) представлен на рис. 4.2.
(кривая насыщения) представлен на рис. 4.2.
 p
p 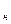

p 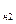 2
2


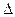 p
p 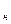



p 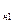 1
1
 |
t 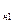 t
t 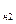 t
t 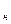
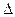 t
t 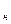

Рис. 4.2. Кривая насыщения
Каждому веществу соответствует своя кривая насыщения. Поскольку для насыщенного пара его давление и температура однозначно определяют друг друга, любой процесс, протекающий в двухфазной области, изображается
на p-v диаграмме линией, совпадающей с кривой насыщения.
Связь между термическими и калорическими величинами в процессе парообразования устанавливает уравнение Клапейрона – Клаузиуса:
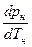 =
= 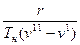 , (4.1)
, (4.1)
где p 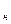 – давление насыщенных паров, Па;
– давление насыщенных паров, Па;
T 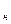 – абсолютная температура насыщения, К;
– абсолютная температура насыщения, К;
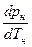 – производная, взятая на кривой фазового перехода;
– производная, взятая на кривой фазового перехода;
r – скрытая теплота парообразования, Дж/кг;
v 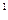 – удельный объём кипящей жидкости, м
– удельный объём кипящей жидкости, м 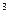 /кг;
/кг;
v 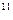 – удельный объём сухого насыщенного пара, м
– удельный объём сухого насыщенного пара, м 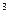 /кг.
/кг.
Степень отклонения свойств насыщенного пара от идеально-газового состояния определяется отличием от единицы коэффициента сжимаемости водяного пара, определяемого по формуле:
 =
= 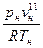 , (4.2)
, (4.2)
где R – газовая постоянная для водяного пара (R = 462 Дж/кг град).
Таким образом, если на основе опытных данных построить зависимость
p 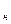 = f (T
= f (T 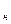 ), то можно графически определить производную от давления по температуре (
), то можно графически определить производную от давления по температуре (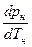 ), и, используя формулу (4.1), рассчитать скрытую теплоту парообразования:
), и, используя формулу (4.1), рассчитать скрытую теплоту парообразования:
r = T 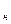 (v
(v 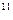 - v
- v 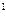 )
) 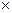
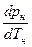 = T
= T 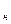 (v
(v 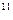 - v
- v 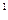 )
) 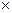
 , Дж/кг (4.3)
, Дж/кг (4.3)
Используя опытные значения p 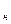 и T
и T 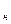 , по формуле (4.2) определяют степень отличие пара от идеального газа. При этом численные значения объёмов v
, по формуле (4.2) определяют степень отличие пара от идеального газа. При этом численные значения объёмов v 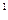 и v
и v 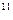 определяются по термодинамическим таблицам для водяного пара (см. табл. 4.1).
определяются по термодинамическим таблицам для водяного пара (см. табл. 4.1).
Уравнение состояния для водяного пара, как для реального газа, весьма сложно и в расчётной практике не применяется. Вследствие этого для практических целей при определении параметров пара и воды на линии насыщения используются справочные таблицы и диаграммы, составленные на основе экспериментальных и теоретических исследований. В этих справочных данных приведены температуры насыщения (t 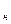 ), давления (p
), давления (p 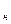 ), удельные объёмы (v
), удельные объёмы (v 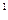 и v
и v 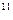 ), скрытая теплота парообразования (r) и другие параметры (см. табл. 4.1).
), скрытая теплота парообразования (r) и другие параметры (см. табл. 4.1).
Таблица 4.1. Параметры насыщенного пара и воды на линии насыщения
Давление насыщения
(абсолютное),
p 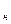 , кг/см , кг/см 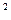
| Температура насыщения,
t 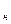 , , 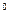 С С
| Удельный объём | Скрытая теплота, r | ||
кипящей жидкости,
v 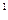 , м , м 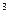 /кг /кг
| сухого пара (насыщенного),
v 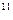 , м , м 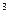 /кг /кг
| ккал/кг | кДж/кг | ||
| 0,2 | 59,67 | 0,001017 | 7,789 | 563,4 | |
| 0,4 | 75,42 | 0,001026 | 4,066 | 554,1 | |
| 0,6 | 85,45 | 0,001033 | 2,782 | 548,0 | |
| 0,8 | 92,99 | 0,001038 | 2,125 | 543,3 | |
| 1,0 | 99,09 | 0,001043 | 1,725 | 539,6 | |
| 1,2 | 104,25 | 0,001046 | 1,455 | 536,3 | |
| 1,4 | 108,74 | 0,001050 | 1,259 | 533,4 | |
| 1,6 | 112,73 | 0,001054 | 1,111 | 530,8 | |
| 1,8 | 116,33 | 0,001057 | 0,9954 | 528,5 | |
| 2,0 | 119,62 | 0,001060 | 0,9018 | 526,4 | |
| 2,2 | 122,65 | 0,001063 | 0,8248 | 524,3 | |
| 2,4 | 125,46 | 0,001065 | 0,7603 | 522,4 | |
| 2,6 | 128,08 | 0,001068 | 0,7055 | 520,7 | |
| 2,8 | 130,55 | 0,001070 | 0,6581 | 518,9 | |
| 3,0 | 132,88 | 0,001072 | 0,6169 | 517,3 |
В настоящей работе процесс парообразования осуществляется в области влажного пара при постоянном объёме (изохорный процесс): v – const. Этот процесс на p-v диаграмме (рис. 4.1) представлен линией 1-2.
Date: 2015-05-08; view: 812; Нарушение авторских прав