
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Вводная часть. Виды теплоёмкостей. Согласно первому закону термодинамики
|
|
Виды теплоёмкостей. Согласно первому закону термодинамики
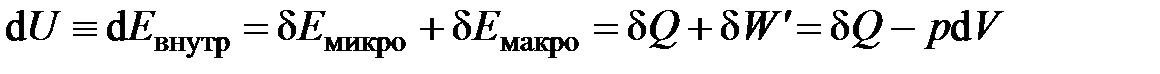
или для удельных величин
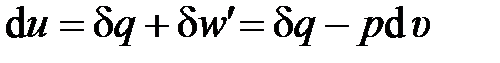 (2.42)
(2.42)
изменение внутренней энергии системы по способу подвода движения и расчета его энергии разбивается на две части (составляющие):
– работу – энергию движения, подводимого (отводимого) к системе макроскопическим путем (та часть изменение внутренней энергии, которая рассчитывается через макроскопические силы и перемещения) и
– теплоту – энергию движения, подведённого (отведенного) к системе микроскопическим путём (та часть изменения внутренней энергии, которая в общем случае не рассчитывается через силы и перемещения).
Возникает вопрос, как же рассчитать теплоту 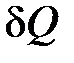 , если её в общем случае не удаётся рассчитать через силы и перемещения (в отдельных случаях теплоту можно рассчитать так же, как и работу через силы и перемещения, например при трении).
, если её в общем случае не удаётся рассчитать через силы и перемещения (в отдельных случаях теплоту можно рассчитать так же, как и работу через силы и перемещения, например при трении).
Из опыта известно, что при подводе тепла, как правило, растёт температура рабочего тела. Поэтому количество подведённого к телу тепла исторически определяли как величину, пропорциональную изменению температуры тела: 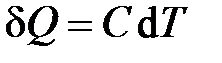 . Коэффициент пропорциональности
. Коэффициент пропорциональности  , позволяющий установить связь между теплотой и изменением температуры тела, называется теплоёмкостью тела. Таким образом, теплоёмкость тела определяется как физическая величина, равная отношению теплоты к изменению температуры тела
, позволяющий установить связь между теплотой и изменением температуры тела, называется теплоёмкостью тела. Таким образом, теплоёмкость тела определяется как физическая величина, равная отношению теплоты к изменению температуры тела
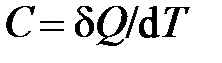 , [
, [  ] = 1 Дж/К.
] = 1 Дж/К.
Теплоемкость тела численно равна теплоте, вызывающей изменение температуры тела на один градус.
Следует заметить, что и при свершении работы изменяется температура тела. Поэтому и работу можно рассчитывать пропорционально изменению температуры: 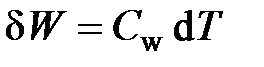 , где
, где 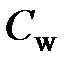 можно назвать «работоемкость», для которой создать специальные таблицы. Однако этого не требуется, т. к. работу гораздо проще рассчитать через силы и перемещения. Следовательно, введение двух физических величин – теплоты и работы – при рассмотрении первого закона термодинамики обусловлено, в первую очередь, различными методами их расчёта.
можно назвать «работоемкость», для которой создать специальные таблицы. Однако этого не требуется, т. к. работу гораздо проще рассчитать через силы и перемещения. Следовательно, введение двух физических величин – теплоты и работы – при рассмотрении первого закона термодинамики обусловлено, в первую очередь, различными методами их расчёта.
В теплотехнических расчётах вместо теплоёмкости тела широко используются удельная, объёмная и молярная теплоёмкости.
Удельной теплоёмкостью называется отношение теплоёмкости тела к его массе
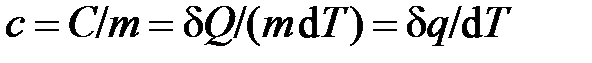 , [
, [ 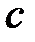 ] = 1 Дж/(кг×К),
] = 1 Дж/(кг×К),
где 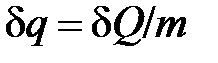 – удельная теплота, Дж/кг (неправильно называть удельную теплоёмкость массовой теплоёмкостью, см. приложение Б).
– удельная теплота, Дж/кг (неправильно называть удельную теплоёмкость массовой теплоёмкостью, см. приложение Б).
Молярной теплоёмкостью называется отношение теплоёмкости тела к количеству вещества (молярности) этого тела:
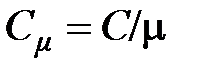 , [
, [ 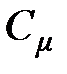 ] = 1 Дж / (моль×К).
] = 1 Дж / (моль×К).
Объёмной теплоёмкостью называется отношение теплоёмкости тела к его объёму, приведённому к нормальным физическим условиям (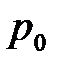 = 101325 Па = 760 мм рт. ст.;
= 101325 Па = 760 мм рт. ст.; 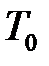 = 273, 15 К (0 оС)):
= 273, 15 К (0 оС)):
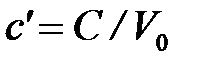 , [
, [ 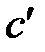 ] = 1 Дж/(м 3×К).
] = 1 Дж/(м 3×К).
В случае идеального газа его объём при нормальных физических условиях (НФУ) вычисляется из уравнения состояния
 .
.
Связь между различными видами теплоёмкости:
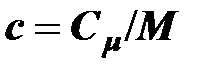 ;
; 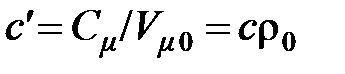 ,
,
где 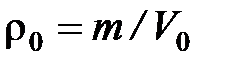 – плотность газа при НФУ,
– плотность газа при НФУ,
 = 22,4141 м3/кмоль – молярный объём, приведённый к НФУ.
= 22,4141 м3/кмоль – молярный объём, приведённый к НФУ.
Теплоёмкость идеального газа зависитот температуры 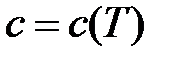 . По этому признаку различают истинную и среднюю теплоёмкости.
. По этому признаку различают истинную и среднюю теплоёмкости.
Истинная теплоёмкость соответствует определённой температуре тела (теплоёмкость в точке), так как определяется при бесконечно малом изменении температуры тела 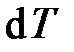
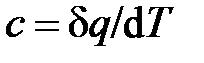 .
.
Значение теплоёмкости, которое принимается постоянным в заданном интервале температур от 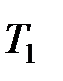 до
до 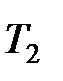 , называется средней теплоёмкостью в данном интервале температур. Она определяется как отношение теплоты к конечному интервалу температур
, называется средней теплоёмкостью в данном интервале температур. Она определяется как отношение теплоты к конечному интервалу температур
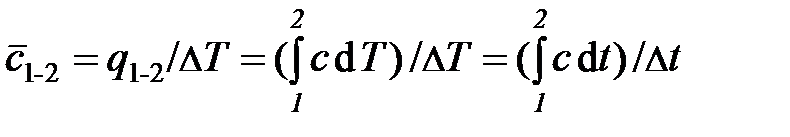 .
.
Согласно первому закону термодинамики (2.42) одному и тому же изменению внутренней энергии соответствует бесчисленное множество сочетаний различных значений теплоты и работы, т. е. при одном и том же изменении температуры (внутренней энергии) тела теплота, а значит и теплоёмкость, будут различными в различных термодинамических процессах.
В случае изотермного процесса (Т = const) температура тела не изменяется (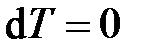 и
и 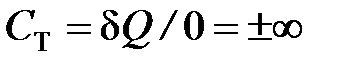 ) и теплоту уже нельзя определить как величину, пропорциональную изменению температуры. В этом случае она определяется из первого закона термодинамики, как работа изменения объёма (d U = 0):
) и теплоту уже нельзя определить как величину, пропорциональную изменению температуры. В этом случае она определяется из первого закона термодинамики, как работа изменения объёма (d U = 0): 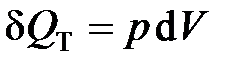 .
.
В случае изобарного процесса (р = const) уравнение первого закона термодинамики (2.42) запишется в виде
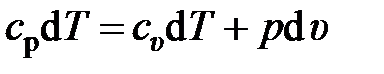 .
.
Откуда выводится известное уравнение Майера
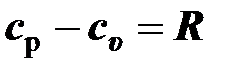 , (2.43)
, (2.43)
согласно которому разность удельной изобарной и изохорной теплоёмкостей для данного газа есть величина постоянная и равная удельной газовой постоянной.
В случае адиабатного процесса теплота равна нулю (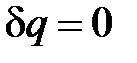 ), а значит и теплоёмкость равна нулю:
), а значит и теплоёмкость равна нулю: 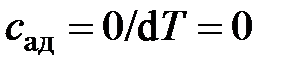 .
.
Уравнение первого закона термодинамики в этом случае запишется в виде
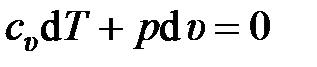 .
.
Откуда выводится уравнение адиабатного процесса (адиабаты)
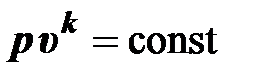 . (2.44)
. (2.44)
Показатель степени, входящий в это уравнение и равный отношению теплоёмкостей, называется показателем адиабаты 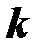 :
:
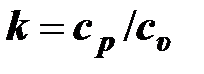 . (2.45)
. (2.45)
Решая совместно (2.43) и (2.45), можно выразить теплоёмкости через 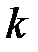 и
и 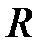 :
:
 ;
; 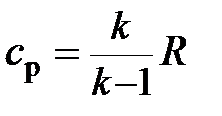 (2.46)
(2.46)
Значения истинных теплоёмкостей и их отношения 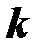 некоторых газов в идеальном состоянии (при
некоторых газов в идеальном состоянии (при 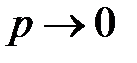 и T C = 0 оС) приведены в таблице 7.
и T C = 0 оС) приведены в таблице 7.
ъ
Таблица 7 – Некоторые характеристики идеальных газов
| Газ | Химическая формула | 
| 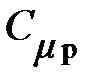
| 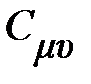
| 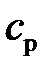
| 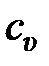
| 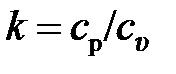
|
| кг/кмоль | кДж/(кмоль×К) | кДж/(кг×К) | |||||
| Гелий | He | 4,0026 | 20,93 | 12,60 | 5,229 | 3,148 | 1,661 |
| Водород | H2 | 2,0158 | 28,58 | 20,270 | 14,180 | 10,056 | 1,410 |
| Метан | CH4 | 16,0426 | 34,74 | 26,42 | 2,165 | 1,647 | 1,315 |
| Аммиак | NH3 | 17,0304 | 35,00 | 26,67 | 2,055 | 1,566 | 1,312 |
| Водяной пар | H2O | 18,016 | 33,504 | 25,190 | 1,8597 | 1,3982 | 1,330 |
| Оксид углерода | CO | 28,0104 | 29,099 | 20,785 | 1,0389 | 0,7421 | 1,400 |
| Азот | N2 | 28,0134 | 29,103 | 20,789 | 1,0389 | 0,7421 | 1,400 |
| Воздух | 28,9642 | 29,050 | 20,736 | 1,0030 | 0,7159 | 1,401 | |
| Кислород | O2 | 31,9988 | 29,224 | 20,910 | 0,9132 | 0,6534 | 1,398 |
| Аргон | Ar | 39,948 | 20,79 | 12,48 | 0,520 | 0,312 | 1,666 |
| Диоксид углерода | CO2 | 44,0098 | 35,989 | 27,675 | 0,8178 | 0,6288 | 1,301 |
| Диоксид серы | SO2 | 64,0588 | 38,85 | 30,52 | 0,607 | 0,476 | 1,273 |
| Пары ртути | Hg | 200,59 | 20,83 | 12,52 | 0,104 | 0,062 | 1,664 |
В среднем по всем газам одинаковой атомарности принято считать, что для одноатомных газов 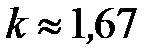 , для двухатомных
, для двухатомных 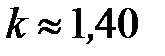 , для трёхатомных
, для трёхатомных 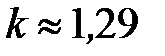 (для водяных паров часто берут точное значение
(для водяных паров часто берут точное значение 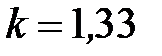 ).
).
В случае произвольного процесса уравнение первого закона термодинамики запишется в виде
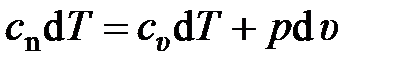 .
.
Откуда по аналогии с уравнением адиабатного процесса (2.44), полученного исторически первым, выводится уравнение политропного процесса (политропы) в виде
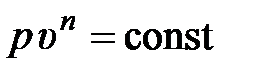 ,
,
где показатель степени 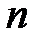 , постоянный для данного процесса, называется показателем политропы
, постоянный для данного процесса, называется показателем политропы
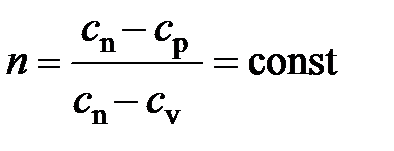 .
.
Таким образом, если процесс политропный и показатель политропы 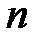 известен, то теплоёмкость политропного процесса
известен, то теплоёмкость политропного процесса 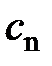 этого процесса может быть определена расчётным путём, не прибегая к эксперименту, по формуле
этого процесса может быть определена расчётным путём, не прибегая к эксперименту, по формуле 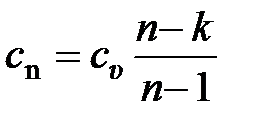 .
.
Расчёт теплоты через средние теплоёмкости осуществляется по формулам:
– для изохорного процесса 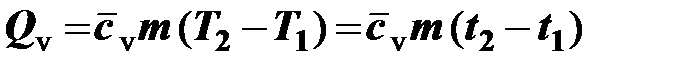
– для изобарного процесса 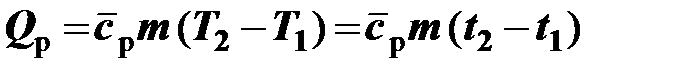 .
.
Date: 2015-05-08; view: 1019; Нарушение авторских прав