
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

ВВЕДЕНИЕ. Методические указания к самостоятельной работе
|
|
ОСНОВЫ
ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ
Методические указания к самостоятельной работе
по дисциплинам ''Химия'' и ''Общая и неорганическая химия''
Для студентов не химического профиля
КУРСК 2012
УДК 543
| Составители: | В.С. Аксенов, | В.С. Мальцева |
Рецензент
доктор химических наук, профессор Ф.Ф. Ниязи
Основы химической термодинамики: методические указания к самостоятельной работе по дисциплинам ''Химия'' и ''Общая и неорга-
| ническая химия'' /Юго-Зап. гос. ун-т; сост.: | В.С. Аксенов, |
В.С. Мальцева. Курск, 2012. 30 с.: ил.3, прилож.1.Библиогр.: с. 30
Излагаются методические материалы по расчету энергетических эффектов в химических реакциях и критериев самопроизвольного протекания процессов.
Предназначены для студентов не химического профиял.
Текст печатается в авторской редакции
Подписано в печать. Формат 60х84 1/16Усл. печ. л. 1,57. Уч.-изд. л. Уч.-изд.л. Тираж 50 экз. Заказ. Бесплатно
Юго-Западный государственный университет.
305040 Курск, ул. 50 лет Октября, 94.
СОДЕРЖАНИЕ
Введение 4
Контрольные вопросы 5
1. Основные понятия термодинамики 6
2. Первый закон термодинамики 8
3. Энтальпия и тепловые эффекты реакций 9
4. Термохимические уравнения 10
5. Термохимические расчеты 11
6. Энтропия и ее изменение при химических
реакциях 15
7. Химический потенциал (энергия Гиббса)
и направленность химических реакций 18
Индивидуальные задания 21
Приложение 28
Библиографический список 30
ВВЕДЕНИЕ
Методические указания предназначены для студентов 1 курса, изучающих дисциплины «Химия» и «Общая и неорганическая химия»
Цель методических указаний - ознакомить студентов с основными термодинамическими функциями, правилами их расчета. Показано как на основании рассчитанных термодинамических функций определяют возможность протекания процессов в определенных условиях. Методические указания помогут студентам проводить термохимические расчет.
Материал обучающей программы разбит на 7 разделов, приведен разбор типовых примеров, варианты индивидуальных заданий.
Данные методические указания могут быть индивидуальной аудиторной самостоятельной работе студентов, а так же в качестве пособия для внеаудиторной подготовки.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Что называется система? Её виды.
2. Что называется внутренней энергии?
3. Сформулируйте I закон термодинамики и каково его математическое выражение.
4. Что называется энтальпией?
5. Сформулируйте закон Гесса.
6. Сформулируйте следствие из закона Гесса?
7. Что называется энтропией?
8. Приведите уравнение Больцмана.
9. Сформулируйте II закон термодинамики.
10. Сформулируйте III закон термодинамики.
11. Что называется энергией Гиббса?
12. Как рассчитывается энергия Гиббса через энтальпию и энтропию?
Основные понятия термодинамики
Все химические процессы сопровождаются энергетическими эффектами, т.е. выделением или поглощением энергии в том или ином виде. Так, в гальванических элементах получается электрическая энергия, которая поглощается при электролизе. Световая энергия выделяется при свечении фосфора (хемилюминисценция), а поглощение световой энергии происходит при разложении солей серебра в фотоматериалах. Механическая энергия выделяется при взрывах, но и взрывы происходят за счет механического воздействия на вещество.
Изучением энергетических эффектов химических реакций занимается термохимия. Термохимия – это раздел термодинамики, изучающий энергетические эффекты различных химических процессов, направление и пределы их самопроизвольного протекания.
Познакомимся с основными понятиями, применяемыми в термодинамике.
Термодинамической системой называют любой объект природы, состоящий из достаточно большого числа структурных единиц (молекул) и отделенный от других объектов реальной или воображаемой границей раздела. Объекты природы, не входящие в систему, называются средой. Системой может быть раствор в колбе, смесь газов определенного (возможно, мысленно выделенного) объема, ткань в красильной ванне, кусок металла и т.д.
Различают гомогенные и гетерогенные системы. Гомогенные системы состоят из одной фазы (истинный раствор, смесь газов); состав, структура и свойства системы одинаковы во всех микроучастках.
Фаза – часть системы, однородная во всех точках по химическому составу и свойствам, и отделенная от других фаз поверхностью раздела.
Гетерогенные системы состоят из нескольких фаз. Например, оксид кальция, хранящийся на воздухе, - четырехфазная система: кристаллы СаО, Са(ОН)2, СаСО3 и газовая фаза – смесь воздуха, СО2 и Н2О. Системы, в состав которых входят вещества или частицы, способные к химическому взаимодействию, называются химическими.
Химические системы характеризуются определенными параметрами, которые называются термодинамическими параметрами. К ним относятся температура Т, давление Р, объем V, масса m и концентрация С.
По характеру обмена веществом и энергией с окружающей средой системы делятся на 3 типа: изолированные, закрытые и открытые. (рис. 1)
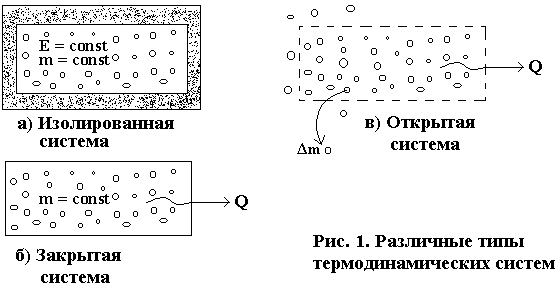 |
Изолированная система – это система, не обменивающаяся с внешней средой ни веществом, ни энергией.
Закрытая система не обменивается со средой веществом, но может обмениваться энергией.
Открытая система может обмениваться со средой как веществом, так и энергией.
Одним из важнейших понятий является состояние системы.
Под состоянием системы понимают совокупность свойств системы, позволяющих определить систему с точки зрения термодинамики.
Переход системы из одного состояния в другое называется процессом. При этом могут изменяться все параметры системы, либо только некоторые. Если процессы перехода системы происходят при постоянстве каких-то параметров системы, то они называются:
а) изобарический (Р = соnst),
б) изотермический (Т = соnst),
в) изохорический (V = соnst),
г) изобарно-изотермический (Р = соnst, Т = соnst) и т.д.
Термодинамика изучает возможности самопроизвольного перехода системы из одного состояния в другое и энергетические эффекты этих переходов.
Термодинамические параметры, не поддающиеся непосредственным измерениям, называются функциями состояния. Функции состояния не зависят от пути перехода системы в данное состояние. Термодинамические свойства системы можно выразить с помощью нескольких функций состояния. При рассмотрении данного вопроса нас будут интересовать следующие функции состояния: внутренняя энергия U, энтальпия Н, энтропия S и химический потенциал (энергия Гиббса) G.
Каждая система – вещество или совокупность веществ – обладает запасом внутренней энергии U, которая складывается из энергии поступательного, колебательного и вращательного движения входящих в ее состав молекул, энергии движения электронов и ядер в атомах, энергии нуклонов, т.е. из энергии всех видов движения частиц, имеющихся в системе. Только кинетическая и потенциальная энергии системы в целом не являются компонентами ее внутренней энергии. Внутренняя энергия зависит как от вида и количества взятого вещества, так и от условий его существования. Абсолютное значение внутренней энергии U вещества неизвестно, т.к. нельзя привести систему в состояние, лишенное энергии. Можно определить изменение внутренней энергии
ΔU = U2 – U1
где ΔU – изменение энергии при переходе из начального состояния U1 в конечное U2. Если U2 > U1, то ΔU > 0; если U2 < U1, то ΔU < 0.
Date: 2015-05-05; view: 784; Нарушение авторских прав