
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Методические указания к выполнению задания
|
|
по теме:"Термодинамический и кинетический
анализ химических систем»
Рассмотрим пример выполнения задания для химической системы
2Н2(г)+02(г) 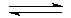 2Н20(г).
2Н20(г).
I. Реакция обратимая, гомогенная, идет в газовой фазе.
Определим величину ΔН°298 (исходные данные берем из табл.2)
ΔН°298 = 2ΔН°298обр.H2O – (2ΔН°298обр.H2+2ΔН°298обр.O2)= 2ΔН°обр.H2O=
=2(-241,84) = -483,68 (кДж) (на 2 моля H2O)
ΔН°298 обр.Н2О= 0,5(-483,8) = -241,89 кДж/моль.<0
Следовательно, реакция экзотермическая.
2. Величина ΔН°298 обр.Н2О через энтальпии связей (данные берем из табл. 3):
ΔН°=4ΔНO-H-2ΔНH-H-ΔН°O-O=4(-463,0)-2(-435)-(-494)=-488 кДж
ΔН°298обр.Н2О = 0,5 (-488) =-244 кДж/моль
Небольшое расхождение объясняется расхождением табличных данных.
3. Для определения направления реакции при 298 К рассчитаем величину ΔG°298 (табл.2):
ΔG°298 = 2ΔG°298обр.H2O-2ΔG°298обр.H2-ΔG°298обр.O2= 2(-228,8)=-457,6 кДж.
Отрицательная величина ΔG°298 свидетельствует о том, что в стандартных условиях реакция самопроизвольно протекает в прямом направлении.
4. Проанализируем зависимость ΔG°т от температуры, взяв произвольно несколько её значений (например, 500К, 1000К 1500К) Изменениями ΔН° и ΔS° с температурой можно пренебречь вследствие их небольшой величины. Изменение энтропии: ΔS°298= 2S°298H2O-2S°298H2-S° 298O2= 2* 188,74 - 2·130.6 –
205=-98,6(Дж/ ·К) = -0,0986(кДж/ К)
ΔG°500=ΔН°298-500·ΔS0298=-483,68-500(-0,0986)=-434,38кДж
ΔG°1000=ΔН°298-1000ΔS0298=-483,68-1000(-0,0986)=~385,08кДж
ΔG°1500 = ΔН°298-1500ΔS0298=-483,68 - I500(-0,0986)=-335,78 кДж
Построим график ΔG°Т =f(Т):
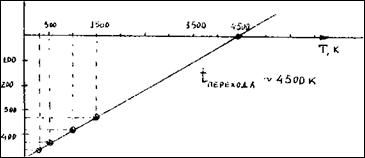 ΔG°Т
ΔG°Т
Рассчитаем температуру, при которой устанавливается химическое равновесие: ΔG°т =0(условие химического равновесия)
ΔН°298 - Т· ΔS°298=0; Травн.= 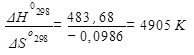
Выпишем знаки термодинамических функций: ΔН < О, ΔS <0 и по таблице 4 определим знак ΔG: при высоких температурах изменение энергии Гиббса может быть положительной величиной, а при достаточно низких температурах - отрицательной. Следовательно, самопроизвольное протекание прямого процесса возможно при достаточно низких температурах; при высоких температурах протекает обратная реакция. Реакция термодинамически обратима.
5. Рассчитаем константу равновесия.
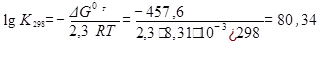
Отсюда Кp = 1080,34 при (298 К)
Такое большое значение константы равновесия свидетельствует о том, что в стандартных условиях идет практически только прямая реакция.
6. Увеличение температуры на 100° не отразится на направлении процесса. Для того, чтобы реакция пошла в обратном направлении необходимо повышение температуры до 4905К (см.п.4) Рассчитаем К5000 (изменениями ΔН° Т и ΔS ° Т с ростом температуры можно пренебречь):
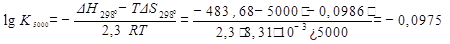
Отсюда K=10-0,.975=0.798<1
Следовательно, при Т=5000 K реакция идет в обратном направлении. При повышении температуры равновесие смещается в сторону эндотермической (обратной) реакции.
7. Так как реакция гомогенная, то выражение для К:
2H2(г)+ O2(г) = 2H2O(г)
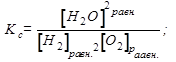
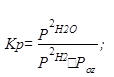
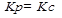
Обозначим начальные концентрации веществ:
[H2]0 = 2 моль/л; [O2]0 = I моль/л; [H2O]0 = 0.
Необходимо рассчитать равновесные концентрации, если К= 1,2032≈1,2. Примем равновесную концентрацию [H2O]равн = х, тогда
[О2]равн=(1-0,5х); [Н2]равн.=(2-х)
Подставим значение равновесных концентраций в выражении для константы равновесия (К) и получаем уравнение с одним неизвестным
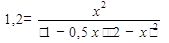
8. Согласно уравнению Менделеева-Клапейрона PV=nRT где n - количество вещества газа (моль).
При неизменных V и Т: 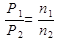 . Реакция идет с уменьшением числа моль газа. Следовательно, давление при протекании реакции в прямом направлении уменьшается.
. Реакция идет с уменьшением числа моль газа. Следовательно, давление при протекании реакции в прямом направлении уменьшается.
9. Реакция экзотермическая и с большей скоростью протекает в прямом
→ →
направлении так какEa1 < Ea2

Энергетический профиль экзотермической реакции
10. По уравнению Аррениуса 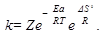
Z - общее число столкновений между молекулами в секунду. Из уравнения видно, что чем больше Еа, тем больше влияние температуры на скорость реакции.
Температурный коэффициент (γ) связан с энергией активации (Еа) соотношением:
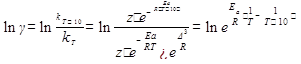
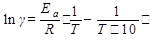
← →
Еа2 > Еа1 следовательно, γ2 > γ1
Таблица 2.
Date: 2015-05-05; view: 459; Нарушение авторских прав