
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Реагирующих веществ, давления и температуры
|
|
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
И
КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
Варианты для выполнения домашнего задания
Великий Новгород
Химическая термодинамика и кинетика химических реакций: Варианты для выполнения домашнего задания./Сост. Е.Н.Бойко, Олисова Г. Н., Ульянова Н. И. – Великий Новгород, НовГУ, 2012.
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
1.Вычислите величины 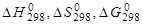 , для реакций, соответствующих Вашему варианту (необходимые для расчетов данные см. в Приложении).
, для реакций, соответствующих Вашему варианту (необходимые для расчетов данные см. в Приложении).
2.Объясните знак изменения энтальпии и энтропии. Возможна ли данная реакция при стандартных условиях?
3.Определите температуру равновесия. При каких температурах протекает реакция (любых, низких, высоких или невозможна ни при каких)?
| Вариант | Уравнения реакций |
| СН3СНО(г) ↔ СН4(г) + СО(г) | |
| 2NO(r) + 2Н2(г) ↔N2(r) + 2Н2O(г) | |
| 2NO(r) + O2(г) ↔ 2NO2(r) | |
| C2Cl4(г)+ С12(г) ↔ С2Сl6(г) | |
| 4Н2(г) + 2NO2(r) ↔4Н2O(г) + N2(r) | |
| 2NO(r) + С12(г) ↔ 2NOCl(r) | |
| 2NO(r) + Н2(г) ↔N2O(r) + Н2O(г) | |
| СO(г)+ Сl2(г) ↔ СОС12(г) | |
| Н2(г) + Вr2(г) ↔2НВr(г) | |
| Н2О2(г) + Н2(г) ↔2Н2О(г) | |
| CdO(TB) + Н2(г) ↔ Cd(ТВ) + Н2О(г) | |
| Н2(г) + I2(г) ↔ 2НI(г) | |
| Fe(ТВ) + С12(г) ↔ FeCl2(TB) | |
| 2NO(r) + Вr2(г) ↔2NOBr(r) | |
| 2N2O5(r) ↔ 4NO2(r) + O2(г) | |
| НСНО(г) ↔ Н2(г) + СО(г) | |
| С(ТВ) + СО2(г) ↔ 2СО(г) | |
| 2О3(г) ↔ ЗО2(г) | |
| СО(г) + Н2О(г) ↔ СО2(г) + Н2(г) | |
| N2(r) + O2(г) ↔ 2NO(r) | |
| 4HBr(г)+O2(г)↔2H2O(г)+2Br2(г) | |
| COCl2(г)↔CO(г)+Cl2(г) | |
| CH4(г)+2O2(г)↔CO2(г)+2H2O(г) | |
| 2HBr(г)↔H2(г)+Br2(г) | |
| 4Н2O(Г) + N2(r) ↔ 4Н2(Г) + 2NO2(r) | |
| 2НI(г) ↔ Н2(г) + I2(г) | |
| 8NO2(г) ↔ N2O(г) + 3N2O5(г) | |
| CH4(г)+O2(г)↔ НСНО(г) + Н2O(г) | |
| 2NOCl(r) ↔2NO(r) + С12(г) | |
| CO(г)+H2(г)↔ НСНО(г) |
Приложение
Термодинамические свойства некоторых веществ
| Вещество | ΔH°f; 298°, кДж/моль | S° 298°, Дж/(К∙моль) | Вещество | ΔH°f; 298°, кДж/моль | S° 298°, Дж/(К∙моль) |
| Вr2(г) | 30,91 | 245,37 | НВr(г) | -36,38 | 198,58 |
| С(ТВ) | 0,00 | 5,74 | НСНО(г) | -115,90 | 218,78 |
| Сd | 0,00 | 51,76 | НJ(г) | 26,36 | 206,48 |
| CdO(TB) | -258,99 | 54,81 | Н2(г) | 0,00 | 130,52 |
| СН3СНО(г) | -166,00 | 264,20 | Н2O(г) | -241,81 | 188,72 |
| СН4(г) | -74,85 | 186,27 | Н2О2(г) | -135,88 | 234,41 |
| C1O2(r) | 104,60 | 257,02 | I2(г) | 62,43 | 260,60 |
| С12(г) | 0,00 | 222,98 | NO(r) | 91,26 | 210,64 |
| СО(г) | -110,53 | 197,55 | NOBr(r) | 81,84 | 272,63 |
| СОС12(г) | -219,50 | 283,64 | NOCl(r) | 52,59 | 263,50 |
| СO2(г) | -393,51 | 213,66 | NO2(r) | 34,19 | 240,06 |
| С2С14(г) | 19,61 | 340,92 | N2(r) | 0,00 | 191,50 |
| С2С16(г) | 27,13 | 398,52 | N2O(r) | 82,01 | 219,83 |
| Fe(TB) | 0,00 | 27,15 | N2O5(r) | 13,30 | 355,65 |
| FeCl2(TB) | -341,01 | 119,66 | O2(г) | 0,00 | 205,04 |
| F2(r) | 0,00 | 202,67 | О3(г) | 142,26 | 238,82 |
КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
Задание 1
Скорость химических реакций и зависимость ее от концентрации
реагирующих веществ, давления и температуры
Для приведенных в заданиях уравнений химических реакций составить математическое выражение закона действия масс и определить, как изменится скорость прямой реакции:
1. При увеличении концентрации первого вещества в «а» раз.
2. При увеличении концентрации второго вещества в «в» раз.
3. При увеличении давления в системе в «с» раз.
4. При условии, когда концентрация реагирующих веществ уменьшается в «d» раз.
5. При повышении температуры на «Δt» градусов, если условно γ = 2.
В таблице задания приводятся цифровые значения величин а, в, с, d, Δt.
Варианты заданий
| Вариант | Уравнения реакций | а | в | с | d | Δt |
| 1. | 2NO+O2=2NO2 | |||||
| 2. | 2CO+O2=2CO2 | |||||
| 3. | 4P(т)+5O2=2P2O5(т) | |||||
| 4. | CH4+2O2=CO2+2H2O(г) | |||||
| 5. | H2+S(т)=H2S | |||||
| 6. | CaO(т)+CO2=CaCO3(т) | |||||
| 7. | Fe2O3(т)+CO=2FeO(т)+CO2 | |||||
| 8. | 2ZnS(т)+3O2=2ZnO(т)+2SO2 | |||||
| 9. | 4FeO(т)+O2=2Fe2O3(т) | |||||
| 10. | N2+3H2=2NH3 | |||||
| 11. | 4NH3+5O2=4NO+6H2O(г) | |||||
| 12. | CO2+H2=CO+H2O(г) | |||||
| 13. | FeO(т)+CO=Fe(т)+CO2 | |||||
| 14. | 2H2S+3O2=2H2O(г)+2SO2 | |||||
| 15. | CO+H2O(г)=CO2+H2 | |||||
| 16. | O2+2H2=2H2O | |||||
| 17. | CuO(т)+H2=Cu(т)+H2O(г) | |||||
| 18. | C2H4+H2=C2H6 | |||||
| 19. | 2NO+Br2=2NOBr | |||||
| 20. | 2NO+O2=2NO2 | |||||
| 21. | CH4+2O2=CO2+2H2O(г) | |||||
| 22. | Fe2O3(т)+CO=2FeO(т)+CO2 | |||||
| 23. | 4P(т)+5O2=2P2O5(т) | |||||
| 24. | H2+Br2(ж) = 2HBr | |||||
| 25. | CaO(т)+CO2=CaCO3(т) | |||||
| 26. | 4NH3+3O2 = 2N2+6H2O(г) | |||||
| 27. | 4HBr(г)+O2 = 2H2O(г)+2Br2(г) | |||||
| 28. | PCl3(г)+Cl2 = PCl5 | |||||
| 29. | C(к)+2H2 = CH4 | |||||
| 30. | 2SO2+O2↔2SO3 |
Date: 2015-05-05; view: 554; Нарушение авторских прав