
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Масса и размеры молекул. Для характеристики масс атомов и молекул применяются величины, получившие название относительной атомной массы элемента (сокращенно - атомной массы) и
|
|
Для характеристики масс атомов и молекул применяются величины, получившие название относительной атомной массы элемента (сокращенно - атомной массы) и относительной молекулярной массы вещества (сокращенно - молекулярной массы)[2].
Атомной массой (Ar) химического элемента называется отношение массы атома этого элемента к 1/12 массы атома 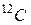 (так обозначается изотоп углерода с массовым числом 12). Молекулярной массой (Mr) вещества называется отношение массы молекулы этого вещества к 1/12 массы атома
(так обозначается изотоп углерода с массовым числом 12). Молекулярной массой (Mr) вещества называется отношение массы молекулы этого вещества к 1/12 массы атома 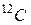 . Как следует из их определения, атомная и молекулярная массы являются безразмерными величинами.
. Как следует из их определения, атомная и молекулярная массы являются безразмерными величинами.
Единица массы, равная 1/12 массы атома 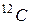 , называется атомной единицей массы (а. е. м.). Обозначим эту единицу, выраженную в килограммах, через m ед. Тогда масса атома, выраженная в килограммах, будет равна Arm ед. , а масса молекулы Mrm ед.
, называется атомной единицей массы (а. е. м.). Обозначим эту единицу, выраженную в килограммах, через m ед. Тогда масса атома, выраженная в килограммах, будет равна Arm ед. , а масса молекулы Mrm ед.
Количество вещества, в котором содержится число частиц (атомов, молекул, ионов, электронов и т. д.), равное числу атомов в 0,012 кг изотопа углерода 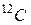 , называется молем. Употребляются также кратные и дольные единицы: киломоль (кмоль), миллимоль (ммоль), микромоль (мкмоль) и т. д.
, называется молем. Употребляются также кратные и дольные единицы: киломоль (кмоль), миллимоль (ммоль), микромоль (мкмоль) и т. д.
Число частиц, содержащееся в моле вещества, называется числом Авогадро. Опытным путем найдено, что число Авогадро равно
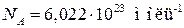 . (1.1)
. (1.1)
Таким образом, например, в моле меди содержится NA атомов меди, в моле воды NA молекул воды, в моле электронов содержится NA электронов и т. д.
Массу моля называют молярной массой M. Очевидно, что M равна произведению NA на массу молекулы Mrm ед:
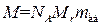 . (1.2)
. (1.2)
В случае углерода 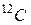
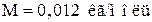 , а масса атома равна 12 m ед. Подстановка этих значений в соотношение (2) дает
, а масса атома равна 12 m ед. Подстановка этих значений в соотношение (2) дает
0,012 (кг/моль) = NA (моль–1)·12 m ед (кг).
Отсюда
 . (1.3)
. (1.3)
Следовательно, масса любого атома равна 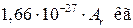 , масса любой молекулы равна
, масса любой молекулы равна 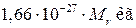 .
.
Из (1.3) вытекает, что произведение NAm ед равно 0,001 кг/моль. Подстановка этого значения в формулу (1.2) дает, что
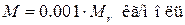 (1.4)
(1.4)
или
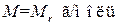 . (1.5)
. (1.5)
Таким образом, масса моля, выраженная в граммах, численно равна относительной молекулярной массе. Однако следует иметь в виду, что, в то время как Mr – величина безразмерная, M имеет размерность кг/моль (или г/моль).
Теперь произведем оценку размеров молекул. Естественно предположить, что в жидкостях молекулы располагаются довольно близко друг к другу. Поэтому приближенную оценку объема одной молекулы можно получить, разделив объем моля какой-либо жидкости, например воды, на число молекул в моле NA. Моль (т. е. 18 г) воды занимает объем 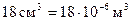 . Следовательно, на долю одной молекулы приходится объем, равный
. Следовательно, на долю одной молекулы приходится объем, равный
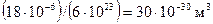 .
.
Отсюда следует, что линейные размеры молекул воды приблизительно равны
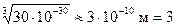 ангстрема.
ангстрема.
Молекулы других веществ также имеют размеры порядка нескольких ангстрем[3].
Date: 2015-05-05; view: 842; Нарушение авторских прав