
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

У.3. Изобразить результаты химического анализа воды графически
|
|
(в виде диаграммы, на графиках-треугольниках и на графике-квадрате Толстихина).
У.3.1. Построить диаграмму.
Диаграмма строится на специальном бланке или сдвоенные прямоугольники вычерчивают самостоятельно в произвольном масштабе.
У.3.1.1.Составить диаграмму катионного состава.
Контрольный вопрос: в каком порядке наносят на диаграмму ионы?
От нижней границы левого прямоугольника, принятой за 0%-экв, откладывают суммарное содержание (Na1++K1+) - в рассматриваемом примере 15%-экв (рис.11А). Выше нарастающим итогом (суммированием) показывают количество Mg2+ и вторая горизонтальная линия в левом прямоугольнике соответствует сумме (Na1++K1+) + Mg2+. В рассматриваемом примере (рис.11 Б) она проводится на уровне 42%-экв (15 +27= 42). Оставшаяся вверху свободная часть диаграммы должна соответствовать содержанию Ca2+, поскольку в сумме все катионы составляют 100%. В приведенном варианте это 58%-экв [100 – (15+27) = 58]. Чтобы убедиться в правильности построения диаграммы проверьте соответствие верхнего поля прямоугольника содержанию иона кальция (рис.11В).
У.3.1.2. Составить диаграмму анионного состава.
Диаграмма составляется аналогично диаграмме катионов. От нижней нулевой границы откладывают содержание Cl1-. В рассматриваемом примере (рис.11А) это 3%-экв. Затем нарастающим итогом (суммированием с Cl1-) проводят границу содержания иона SO42-. На рисунке (рис.11Б) это 15%-экв (3+12=15). Как и в предыдущем случае, для проверки правильности
составления этой части диаграммы необходимо проверить соответствие
оставшегося вверху свободного пространства (рис.11В) содержанию иона HCO31- (85%-экв).
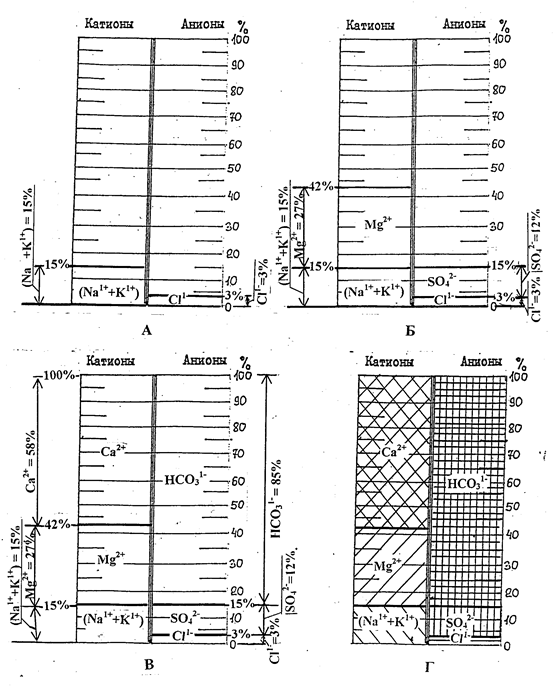 |
Рис.11. Построение столбчатой диаграммы химического состава воды:
А – нанесение данных по содержанию первого катиона (Na1++K1+) и аниона (Cl-1); Б - нанесение данных по содержанию второго катиона (Mg2+) и аниона (SO42-); В – проверка правильности построения по содержанию последнего (третьего) компонента – ионов Ca2+ и HCO31-. Г – окончательный вид построенной диаграммы.
У.3.1.3. Оформление диаграммы.
Участки диаграммы, соответствующие содержанию разных ионов, следует закрасить разными цветами или заштриховать и на них необходимо указать символ этого иона. Принято употреблять следующие цвета: HCO31-голубой, SO42- - желтый, Cl1- – зеленый; Ca2+ - синий, Mg2+ - красный, (Na1++K1+) - зеленовато-желтый. В окончательном виде диаграмма приведена на рисунке (рис.11Г).
У. 3.2. Нанести данные химического анализа на графики-треугольники.
Контрольный вопрос: каким образом на графике-треугольнике показывают химический состав воды?
У.3.2.1. Найти точку, характеризующую катионный состав воды.
Контрольный вопрос: Какие вершины треугольника соответствуют 100% содержанию Ca2+, Mg2+ и (Na1++K1+) и какие основания – 0% этих катионов?
·
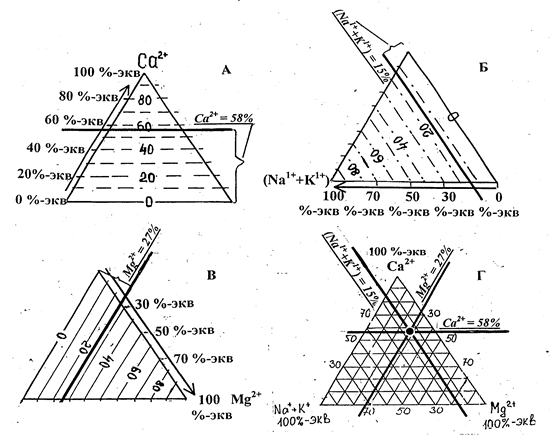 |
Провести линию, соответствующую содержанию Ca2+ (в данном вариан-
те – 58%-экв). Эта линия проходит параллельно нижнему основанию треугольника (рис.12А).
Рис.12. Нахождение на графике-треугольнике точки катионного состава воды. А, Б и В – проведение линий, показывающих содержание Ca2+, Mg2+ и (Na1++K1+). Г – получение искомой точки катионного состава анализируемой воды.
· Параллельно правой стороне треугольника провести линию (на рис.12Б – 15%-экв), соответствующую содержанию (Na1++K1+)
· Линия, параллельная левой стороне треугольника (рис.12В), отвечает содержанию Mg2+ (в примере – 27%-экв).
Все три линии пересекаются в одной точке, которая и изображает катионный состав воды (рис.12Г).
У.3.2.2. Найти на графике точку, характеризующую анионный состав воды.
Контрольный вопрос: Какие вершины этого треугольника соответствуют 100% содержанию HCO31-, SO42- и Cl-1; какие основания – 0%?
·
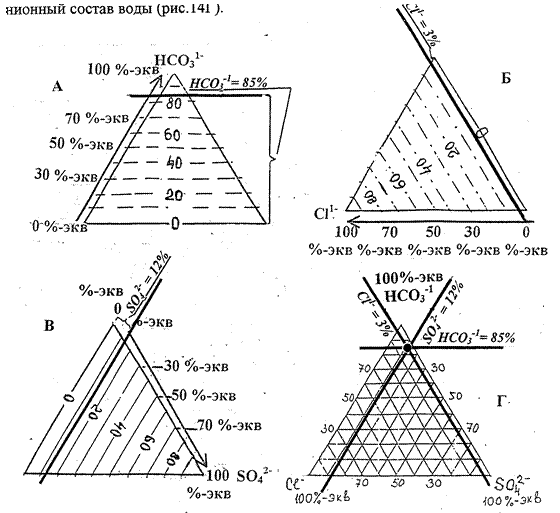 |
Провести линию, показывающую содержание HCO31- (в данном примере – 85%-экв). Она проходит параллельно нижнему основанию треугольника (рис.13А).
Рис.13. Нахождение на графике-треугольнике точки анионного состава воды. А, Б и В – проведение линий, показывающих содержание HCO31-, Cl-1 и SO42-. Г – искомая точка анионного состава анализируемой воды.
· Провести линию содержания Cl-1 (в рассматриваемом варианте 3%-экв), проходящую параллельно правой стороне треугольника (рис.13Б).
· Провести линию, соответствующую содержанию SO42- (в примере – 12%-экв), которая проходит параллельно левой стороне треугольника (рис.13В).
Три проведенные линии пересекаются в одной точке, которая и изображает анионный состав воды (рис.13Г).
Примечание. Линии, проводившиеся для нахождения точек на обоих треугольниках, имеют «служебный», технический характер и на итоговых графиках отсутствуют (рис.14), но при выполнении учебной работы их можно оставить, как изображено на рисунках 12Г и 13Г.
На рисунке 14 для сравнительной оценки состава анализируемой воды дополнительно нанесены данные химического состава океанической воды и поверхностных вод суши.
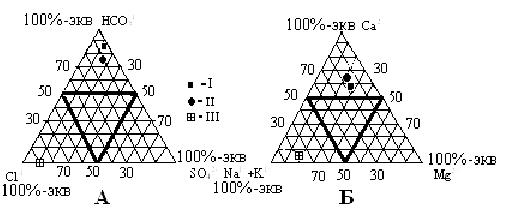
Рис. 14. Анионный (А) и катионный (Б) состав анализируемой подземной воды (I), поверхностных вод суши (II) и океанической воды (III).
У.3.3. Нанести данные химического анализа на график-квадрат
(квадрат Толстихина).
Контрольный вопрос: как на графике-квадрате показывают химический состав воды?
У.3.3.1. Провести линию катионного состава воды.
На нижней стороне квадрата (рис.15А) находим точку, соответствующую данному содержанию (Na1++K1+), количество которого возрастает справа налево от 0 до 100%-экв (на рисунке - 15%-экв). Через найденную точку проводим вертикальную линию (рис.15Б), которая должна пересечь верхнюю сторону квадрата в точке, отвечающей сумме Ca2++Mg2+ (в рассматриваемом примере – 85%-экв), поскольку все катионы вместе составляют 100%.
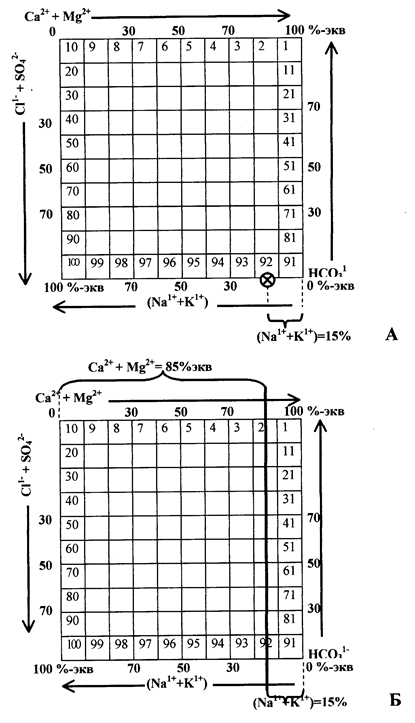 |
Рис.15. Проведение на графике-квадрате линии катионного состава:
А – нахождение точки на нижней стороне квадрата с данным (15%-экв)
содержанием (Na1++K1+), Б – вертикальная линия соответствующая 15% (Na1++K1+) и, одновременно, 85% Ca2++Mg2+.
У.3.3.2. Провести линию анионного состава воды.
По правой стороне квадрата (рис.16А) от нижней (правой же) вершины
отсчитываем содержание HCO31- (в рассматриваемом варианте – 85 %-экв).
Через эту точку проводим горизонтальную линию, соответствующую данному количеству гидрокарбонатного иона (рис.16Б). Противоположную (левую)
 |
сторону квадрата она пересекает в точке суммарного содержания SO42- и Cl-1 (на рисунке – 12+3=15 %-экв).
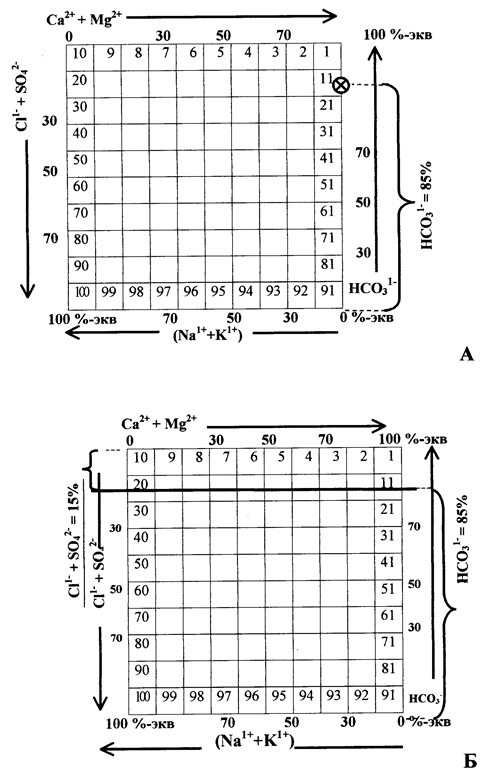
Рис.16. Проведение на графике-квадрате линии анионного состава:
А – нахождение точки на правой стороне квадрата с данным (85%)
содержанием HCO31-,
Б – горизонтальная линия соответствующая 85% HCO31- и 15% SO42- + Cl-1.
 |
Обе проведенные линии, «катионная» и «анионная» пересекаются, естественно, в одной точке, которая и характеризует ионный состав воды (рис. 17А).
Рис.17. График-квадрат Толстихина с данными химического состава:
А - подземной воды в рассматриваемом примере; Б - анализируемой подземной воды (I), поверхностных вод суши (II) и океанической воды (III)
Примечание. Линии, проведенные для нахождения точки в квадрате, как и на графиках-треугольниках имеют «служебный», технический характер и на итоговом квадрате отсутствуют (рис.18Б), но при выполнении учебной работы их можно оставить. На рисунке 18Б дополнительно нанесены данные химического состава океанической воды и поверхностных вод суши.
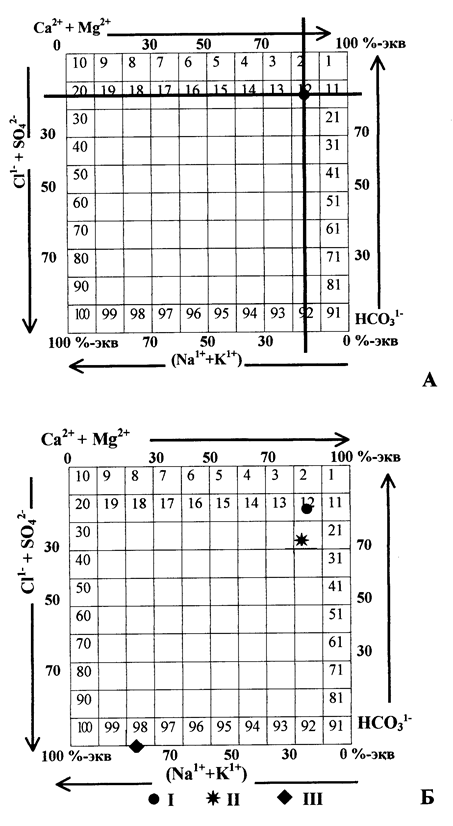
У.3.3.3. Назвать воду по классификации Толстихина.
Название воды – это номер одного из 100 маленьких квадратов, на который разделен большой квадрат.
Контрольный вопрос: В каком порядке пронумерованы маленькие квадраты?
В рассматриваемом примере точка химического состава воды находится в маленьком квадрате с номером 12 (на рисунке 18 дополнительно пронумерован горизонтальный ряд с этим квадратом). Ответ: «вода соответствует №12 по классификации Толстихина» следует записать под графиком-квадратом. Если искомая точка попадет на линию между двумя квадратами, то в названии указывают оба номера, а если в вершину четырех смежных квадратов, то номера всех четырех квадратов.
У.4. Дать оценку некоторых свойств воды –
общей минерализации, жесткости, кислотности.
В учебной работе предусмотрена характеристика воды по следующим параметрам: минерализация, жесткость (общая, устранимая, постоянная), pH. Оценка воды дается путем сравнения результатов химического анализа с имеющимися классификациями природных вод. Дополнительно необходимо дать характеристику воды по классификации О.А. Алекина.
У.4.1. Оценка воды по общей минерализации.
Контрольные вопросы:
- Что такое общая минерализация и как ее можно определить;
- Классификация воды по общей минерализации?
В таблице «химический состав воды» (рис. 7-9) подсчитана сумма всех ионов, определенных в воде. Эту сумму и надо сравнить с классификацией воды по общей минерализации (см. табл.2 на стр.7)
Обратите внимание, что общая минерализация, определяемая как сумма всех содержащихся в воде ионов, или как сухой остаток, в задании даны в миллиграммах на литр, а в нормативном документе (табл.2) - в граммах на литр.
В рассматриваемом варианте:
Общая минерализация – 0,446 г/л. Оценка: вода пресная.
У.4.2. Оценка воды по жесткости.
Контрольные вопросы:
- Как и в каких единицах определяют жесткость воды?
- классификация воды по общей жесткости?
- Что такое устранимая и неустранимая жесткость, как их определяют?
- Почему неустранимую жесткость называют карбонатной;
У.4.2.1. Общая жесткость.
· Подсчитать сумму катионов Ca2+ и Mg2+ в мг-экв/л. Полученный результат представляет общую жесткость, измеренную также в мг-экв/л.
rCa2+ + rMg2+ = общая жесткость.
Примечание: буква “r”, стоящая перед символами ионов означает, что следует складывать численные значения ионов.
В рассматриваемом примере:
Общая жесткость = 5,0 мг-экв/л (3,4 мг-экв/л +1,6 мг-экв/л)
· Оценить общую жесткость воды.
Для этого сравнить жесткость анализируемой воды с классификацией подземных вод по этому параметру (табл.3, стр.7).
Вывод для рассматриваемого варианта: вода умеренно жесткая.
У.4.2.2. Устранимая жесткость (карбонатная).
· Определить устранимую жесткость, численно равную содержанию иона HCO31- в мг-экв/л.
В приведенном примере устранимая (карбонатная) жесткость равна:
r HCO31- = 4,9 мг-экв/л.
У.4.2.3. Неустранимая жесткость.
· Для определения неустранимой жесткости из полученного значения общей жесткости следует вычесть величину устранимой:
Постоянная (неустранимая) жесткость = (r Ca2+ + rMg2+) - r HCO31-, при этом, если получаемый результат отрицателен, в ответе следует записать
«0 мг-экв/л». Это значит, что содержание гидрокарбонатного иона больше количества кальция и магния, которых после кипячения в воде не остается.
В рассматриваемом варианте: постоянная жесткость – 0,1 мг-экв/л [(3,4 мг-экв/л +1,6 мг-экв/л) – 4,9 мг-экв/л = 0,1 мг-экв/л.], то есть после кипячения вода - очень мягкая.
У.4.3. Оценка воды по величине рН.
Контрольный вопрос:
- классификация воды по величине рН?
Показатель рН дан в качестве исходного в результатах анализа воды. Его значение следует сравнить с классификацией воды по степени кислотности (табл.4, стр.7) и записать оценку.
В приведенном примере рН=7,6. Оценка: вода слабощелочная.
У.4.4.Составление таблицы оценки свойств воды.
Выполненную оценку свойств воды целесообразно представить в виде таблицы 10, включив в нее и характеристику воды по классификации О.А. Алекина, выполненную ранее (раздел У.2.3.)
· В первый столбец таблицы записать названия свойств по которым оценивается вода, а также пункты классификации Алекина (на типографском бланке этот этап работы уже выполнен).
· Во второй столбец внести данные обрабатываемого анализа воды, в том числе использованные для определения класса, группы и типа воды по Алекину.
· В третий столбец записать результаты оценки свойств воды по предусмотренным показателям а также название класса, группы типа воды (включая их краткую запись) по классификации Алекина.
Таблица № 10
Оценка воды.
| Показатели свойств воды | Результаты анализа | Оценка воды | |
| Общая минерализация | 0,446 г/л | Пресная | |
| Общая жесткость | 5,0 мг-экв/л | Жесткая | |
| Устранимая жесткость (карбонатная) | 4,9 мг-экв/л | После кипячения – очень мягкая | |
| Неустранимая (постоянная) жесткость | 0,1 мг-экв/л | ||
| Кислотность (рН) | 7,6 | Слабо щелочная | |
| Классификация Алекина | класс | HCO31- = 85%-экв. | Гидрокарбонатный |
| группа | Ca2+ = 58%-экв | Кальциевая | |
| тип | rHCO31-< rCa2++rMg2+ < rHCO31-+rSO42-, 4, 9< (3,4+1,6) < (4,9+0,7) | II (пресная жесткая) | |
| Краткая запись | СCaII |
Date: 2015-06-08; view: 2284; Нарушение авторских прав