
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Тема 1. Уравнение состояния идеального газа
|
|
Состояние системы задается термодинамическими параметрами – совокупностью физических величин, характеризующих свойства термодинамической системы, например, давлением р, объемом V и температурой Т. Между этими параметрами существует определенная связь, называемая уравнением состояния.
Для идеального газа уравнением состояния является уравнение Клапейрона – Менделеева:
 ,
,
где m – масса газа,  – молярная масса (масса одного моля вещества),
– молярная масса (масса одного моля вещества),
 – количество вещества,
– количество вещества,
R – универсальная газовая постоянная,  .
.
(Идеальным называется такой газ, в котором считается, что собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда, в котором он находится, силы взаимодействия между молекулами газа отсутствуют, а столкновения между молекулами газа абсолютно упругие.)
Исходя из уравнения Клапейрона – Менделеева и понятия концентрации n (n – число молекул в единице объема:  , где N – число всех молекул газа), можно получить уравнение состояния идеального газа в ином виде:
, где N – число всех молекул газа), можно получить уравнение состояния идеального газа в ином виде:
 , то есть
, то есть  ,
,
где  – постоянная Авогадро – число молекул в одном моле вещества,
– постоянная Авогадро – число молекул в одном моле вещества,
 ,
, 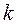 – постоянная Больцмана.
– постоянная Больцмана.
Date: 2015-11-15; view: 388; Нарушение авторских прав