
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Ход урока. I. Организационно – психологический этап
|
|
I. Организационно – психологический этап
Ожидаемый результат: создание благоприятной эмоциональной обстановки, «погружение» учащихся в атмосферу урока.
Деятельность учителя: - создает доброжелательную атмосферу в классе, объясняет основные задачи урока.
Деятельность учащихся: настраиваются на работу, внутренне организуются.
II. Ориентировочно – мотивационный этап
Ожидаемые результаты: активизация ранее полученных знаний, умений и навыков, познавательного интереса учащихся.
Деятельность учителя: проверка домашнего задания.
Учитель проводит проверочную работу (2 варианта).
Вариант 1
Задача 1.
При выпаривании 10%-го раствора сульфата натрия массой 500 г получили раствор массой 200 г. Какова массовая доля соли (%) в полученном растворе?
Задача 2.
Вычислить молярную концентрацию раствора серной кислоты, если массовая доля H2SO4 в этом растворе 12%. Плотность раствора 1,08 г/см3 при 200С?
Вариант 2
Задача 1.
К 10%-му раствору сахара массой 250 г прилили воду объемом 150 см3. Какова массовая доля сахара в новом растворе?
Задача 2.
Молярная концентрация раствора едкого кали (КОН) равна 3,8 моль/дм3. Вычислить массовую долю(%) КОН в этом растворе.
Деятельность учащихся: учащиеся выполняют задания проверочной работы.
III. Операционно – познавательный этап
Ожидаемые результаты: приобретение учащимися знаний и умений в рамках изучаемой темы.
Деятельность учителя: организует работу с учебником, демонстрирует опыт; излагает новый материал; вовлекает учащихся в активное обсуждение ранее изученного материала.
1. Работа учащихся с учебником (стр. 154), заполнение таблицы в процессе беседы с учащимися.
| Электролиты | Неэлектролиты |
| Вещества с ионной и сильнополярной ковалентной связью: соли – NaCl, KNO3, CuSO4 и др. щелочи – NaOH, KOH, Ba(OH)2 и др. кислоты – HCl, H2SO4, HNO3 и др. | Вещества с неполярной или слабополярной ковалентной связью: кислород, винный спирт, глюкоза, сахар, парафин и другие органические вещества |
Вывод: электролитическая диссоциация – это распад электролита на ионы при растворении в воде или расплавлении.
2. С использованием настенной таблицы «Механизм диссоциации веществ с иным типом связи» учитель объясняет сущность процесса на примере диссоциации соли NaCl: NaCl = Na+ + Cl-
Следующая задача – выяснить, как происходит диссоциация полярных ковалентных соединений. На схеме диссоциации хлороводорода (настенная таблица) рассматриваем сущность процесса: гидратация молекул в момент соприкосновения газа с водой, образование гидратированных ионов H3O+ и Cl– • (H2O)4
Знакомим со строением иона гидроксония (стр. 155 учебника) поясняем донорно-акцепторный механизм образования связи в ионе гидроксония. Учащиеся составляют уравнения диссоциации хлороводорода:
HCl + H2O = H3O+ + Cl–
Отмечаем, что хлорид-ион в растворе также гидротирован.
Учащиеся рассматривают рис. 60 стр. 155 учебника и составляют уравнение диссоциации азотной кислоты: HNO3 + H2O = H3O+ + NO3-
Вспоминаем понятия катион, анион.
3. Учитель показывает записанные за доской уравнения диссоциации:
а) NaOH = Na+ + OH-
Ba(OH)2 = Ba2+ + 2OH-
б) KCl = K+ + Cl-
Na2SO4 = 2Na+ + SO4-
в) HCl = H+ + Cl-
H2SO4 = H+ + HSO4-
HSO4- = H+ + SO42-
___________________________________________________
H2SO4 = 2H+ + SO42-
Обращаем внимание учащихся на то, что в зависимости от природы веществ, т.е. от прочности связи между ионами, зависящий от их зарядов и радиусов, равновесие при диссоциации устанавливается по-разному. Например, что можно сказать о сравнительном числе ионов гидроксония в растворах соляной и уксусной кислот одинаковой концентрации на основании опытов?
Демонстрируем опыты: а) испытание 0,5%-х растворов соляной и уксусной кислот индикатором метиловым оранжевым; б) проверка электрической проводимости данных растворов.
Учащиеся приходят к выводу: в растворе соляной кислоты ионов больше, чем нераспавшихся молекул, а в растворе уксусной кислоты – наоборот. Учитель дает понятие о степени диссоциации, разъясняет смысл формул:  =
= 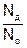 , где N = n ∙ NA, отсюда
, где N = n ∙ NA, отсюда  =
=  =
= 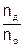 на конкретном примере.
на конкретном примере.
Допустим  (HCl) = 0,78 или 78%. Тогда при растворении каждых 100 молекул хлороводорода соотношение частиц при химическом равновесии будет таким:
(HCl) = 0,78 или 78%. Тогда при растворении каждых 100 молекул хлороводорода соотношение частиц при химическом равновесии будет таким:
HCl ⇄ H+ + Cl -
78 78 78
молекул ионов ионов
продиссоцировало
22
молекулы
осталось
Всего в данном растворе будет 178 частиц (ионов и молекул).
Вывод: если  близка к 1, то электролит сильный, если
близка к 1, то электролит сильный, если  близка к 0, то электролит слабый. Учащиеся называют примеры сильных и слабых электролитов.
близка к 0, то электролит слабый. Учащиеся называют примеры сильных и слабых электролитов.
Деятельность учащихся: усваивают новый материал, составляют уравнения диссоциации и анализируют их.
IV. Контрольно – коррекционный этап
Ожидаемые результаты: учащиеся выполняют задания, способствующие обобщению изученного материала.
Форма работы: индивидуальная, фронтальная
Оборудование: кодоскоп, экран (компьютер, мультимедийный проектор).
Деятельность учителя: на экране демонстрируются задания, которые обсуждают и выполняют учащиеся.
Проецируем на экран основные положения теории электролитической диссоциации, а учащиеся получают листы-конспекты с текстом на слайде. Учитель комментирует, а учащиеся делают записи в тетрадь.
Основные положения теории электролитической диссоциации (ТЭД) сформировал в 1887 году шведский ученый Сванте Аррениус.
1. Молекулы электролитов при растворении в воде или расплавлении распадаются на ионы.
Процесс распада молекул электролитов на ионы в водном растворе или расплаве называется электролитической диссоциацией или ионизацией.
Ионы – это атомы или группы атомов, имеющие положительный или отрицательный заряд. Ионы могут быть простые (Na+, Mg2+, S2-, Cl-); сложные (SO42-, NH4+, SO32-).
2. В растворе или расплаве электролитов ионы движутся хаотически. При пропускании через раствор или расплав электрического тока положительно заряженные ионы движутся к отрицательно заряженному электроду (катоду), а отрицательно заряженные ионы к положительно заряженному электроду (аноду).
Поэтому положительные ионы называют катионами, а отрицательные ионы – анионами.
К катионам относятся: ион водорода H+; ион аммония NH4+; ионы металлов Na+, K+, Ca2+, Al3+.
К анионам относятся: гидроксид-ион ОН- ; анионы кислотных остатков: Cl - ; S2-; NO3-; SO42-; PO43-.
4. Диссоциация многих электролитов – процесс обратимый. Это означает, что одновременно идут два противоположных процесса: распад молекул на ионы (ионизация или диссоциация) и соединение ионов в молекулы (ассоциация или моляризация).
Например: ионизация (диссоциация)
 HNO2 H+ + NO2-
HNO2 H+ + NO2-
 ассоциация (моляризация)
ассоциация (моляризация)
Деятельность учащихся: записывают в тетради предложенные знания, участвуют в обсуждении.
Date: 2015-11-15; view: 542; Нарушение авторских прав