
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Контрольные задания (334-345)
|
|
334. К какому классу соединений относятся вещества, полученные при действии избытка гидроксида натрия на растворы ZnCl2, CdCl2, HgCl2? Составьте молекулярные и ионные уравнения соответствующих реакций.
335. Определив направление реакций и нужную среду, подберите коэффициенты с электронно-ионными уравнениями и напишите полные уравнения реакций, которые возможны в системах:
СrO2-+ Вr2 → СrО42- + 2Вr-;
Сr3+ + Fe3+ > Сr2072-+ Fe2+;
336. При прокаливании металлического титана образуется белый порошок, который растворяется в концентрированной серной кислоте и сплавляется со щелочью. Что представляет собой это соединение? Напишите уравнения всех указанных реакций.
337. Золото растворяется в царской водке, приобретая при этом высшую степень окисления. Составьте электронные и молекулярно-ионные уравнения реакции.
338. При сливании растворов нитрата серебра ицианида калия выпадает осадок, который легко растворяется в избытке KCN. Какое комплексное соединение при этом получается? Составьте молекулярные и ионные уравнения соответствующих реакций,
339. В присутствии влаги и диоксида углерода медь окисляется и покрывается зеленым налетом. Что произойдет, если на него подействовать хлороводородной кислотой? Напишите уравнения соответствующих реакций. Окислительно-восстановительную реакцию составьте на основании электронных уравнений,
340. Чем отличается взаимодействие гидроксидов кобальта (III) и никеля(III) с кислотами от взаимодействия гидроксида железа (III) с кислотами? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
341. Ванадий получают алюмотермически восстановлением оксида ванадия (V), который легко растворяется в щелочах. Напишите уравнения соответствующих реакций. Уравнения окислительно-восстановительных реакций составьте на основе электронных уравнений.
342. Могут ли в растворе существовать совместно следующие вещества:
а)FеСl3 и SnCl2; б) FeS04 и NaOH; в) FeCl3 и K3[Fe(CN)6].
Для взаимодействующих веществ составьте уравнения реакций.
343. Получите хромат натрия сплавлением хромита железа Fe(Cr02)2 с карбонатом натрия в присутствии кислорода. Составьте электронные и молекулярные уравнения реакции.
344. На какие продукты разлагается благодаря своей непрочности марганцовистая кислота Н2Мn04? К какому типуотносится эта реакция?
345. По каким внешним признакам можно определить, в какой среде проходила реакция восстановления КМnO4? Допишите уравнения следующих реакций:
а) КМn04 + Na2S03 + H2S04 →
б) KMn04 + Na2S03 + Н20 →
в) КМn04 + Na2S03 + КОН →
346. Что обычно является растворителем для металлической платины? Составьте электронные и молекулярное уравнения.
ПРИЛОЖЕНИЕ
Таблица 1
Относительная электроотрицательность элементов (ЭОЭ)
| Элемент | ОЭО | Элемент | ОЭО | Элемент | ОЭО |
| H | 2,1 | Cu | 1,9 | Ba | 0,8 |
| Li | 1,0 | Zn | 1,6 | La-Lu | 1,0-1,2 |
| Be | 1,5 | Ga | 1,6 | Hf | 1,3 |
| B | 2,0 | Ge | 1,8 | Ta | 1,5 |
| C | 2,5 | As | 2,0 | W | 1,7 |
| N | 3,0 | Se | 2,4 | Re | 1,9 |
| O | 3,5 | Br | 2,8 | Os | 2,2 |
| F | 4,0 | Rb | 0,8 | Ir | 2,2 |
| Na | 0,9 | Sr | 1,0 | Pt | 2,2 |
| Mg | 1,2 | Y | 1,2 | Au | 2,4 |
| Al | 1,5 | Zr | 1,4 | Hg | 1,9 |
| Si | 1,8 | Nb | 1,6 | Tl | 1,8 |
| P | 2,1 | Mo | 1,8 | Pb | 1,9 |
| S | 2,5 | Tc | 1,9 | Bi | 1,9 |
| Cl | 3,0 | Ru | 2,2 | Po | 2,0 |
| K | 0,8 | Rh | 2,2 | At | 2,2 |
| Ca | 1,0 | Pd | 2,2 | Fr | 0,7 |
| Sc | 1,3 | Ag | 1,9 | Ra | 0,9 |
| Ti | 1,5 | Cd | 1,7 | Ac | 1,1 |
| V | 1,6 | In | 1,7 | Th | 1,3 |
| Cr | 1,6 | Sn | 1,8 | Pa | 1,4 |
| Mn | 1,5 | Sb | 1,9 | U | 1,4 |
| Fe | 1,8 | Te | 2,1 | Np - No | 1,3 – 1,4 |
| Co | 1,9 | I | 2,5 | - | - |
| Ni | 1,9 | Cs | 0,7 | - | - |
Таблица 2
Стандартные энтальпии (теплоты) образования ∆Н0f некоторых веществ
| Вещество | Состояние | ∆Н0f, кДж/моль | Вещество | Состояние | ∆Н0f, кДж/моль |
| C2H2 | г | +226,75 | CO | г | -110,52 |
| CS2 | г | +115,28 | CH3OH | г | -201,17 |
| NO | г | +90,37 | C2H3OH | г | -235,31 |
| C6H6 | г | +82,93 | H2O | г | -241,83 |
| C2H4 | г | +52,28 | H2O | ж | -285,84 |
| H2S | г | -20,15 | NH4Cl | к | -315,39 |
| NH3 | г | -46,19 | CO2 | г | -393,51 |
| CH4 | г | -74,85 | Fe2O3 | к | -822,10 |
| C2H6 | г | -84,67 | Ca(OH)2 | к | -986,50 |
| HCl | г | -92,31 | Al2O3 | к | -1669,80 |
Таблица 3
Стандартные абсолютные энтропии S0298 некоторых веществ
| Вещество | Состояние | S0298, Дж/(моль∙К) | Вещество | Состояние | S0298, Дж/(моль∙ К) |
| C | алмаз | 2,44 | H2O | г | 188,0 |
| C | графит | 5,69 | N2 | г | 191,49 |
| Fe | к | 27,2 | NH3 | г | 192,50 |
| Ti | к | 30.7 | CO | г | 197,91 |
| S | ромб | 31,9 | C2H2 | г | 200,82 |
| TiO2 | к | 50.3 | O2 | г | 205,03 |
| FeO | к | 54,0 | H2S | г | 205,64 |
| H2O | ж | 69,94 | NO | г | 210,20 |
| Fe2O3 | к | 89,96 | CO2 | г | 213,65 |
| NH4Cl | к | 94.5 | C2H4 | г | 219,45 |
| CH3OH | ж | 126,8 | Cl2 | г | 222,95 |
| H2 | г | 130,59 | NO2 | г | 240,46 |
| Fe3O4 | к | 146,4 | PCl3 | г | 311,66 |
| CH4 | г | 186,19 | PCl5 | г | 352,71 |
| HCl | г | 186,68 | Cr2O3 | к | 81,2 |
| Cr | к | 23,6 | SO2 | г | 241,8 |
Таблица 4
Стандартные энергии Гиббса образования ∆G°f некоторых веществ
| Вещество | Состояние | ∆G°f, кДж/моль | Вещество | Состояние | ∆G°f, кДж/моль |
| BaCO3 | к | -1138,8 | FeO | к | -244,3 |
| CaCO3 | к | -1128,75 | H2O | ж | -237,19 |
| Fe3O4 | к | -1014,2 | H2O | г | -228,59 |
| BeCO3 | к | -944,75 | PbO2 | к | -219,0 |
| CaO | к | -604,2 | CO | г | -137,27 |
| BeO | к | -581,61 | CH4 | г | -50,79 |
| BaO | к | -628,4 | NO2 | г | +51,84 |
| CO2 | г | -394,38 | NO | г | +86,69 |
| NaCl | к | -384,03 | C2H2 | г | +209,2 |
| ZnO | к | -318,2 | NaF | к | -541,0 |
Таблица 5
Константы диссоциации некоторых слабых электролитов
| Электролит | Формула | К1 | К2 |
| Синильная | HCN |  
| |
| Фтороводородная | HF | 
| |
| Азотистая | HN02 | 
| |
| Угольная | Н2СОэ | 
| 
|
| Сероводородная | H2S | 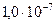
| 
|
| Сернистая | H2S03 | 
| 
|
| Селеноводородная | H2Se | 
| 
|
| Уксусная | СН3СООН | 
| |
| Гидроксид аммония | NH4ОН | 
| |
| Гидроксид железа (II) | Fe(OH)2 | 
| |
| Гидроксид свинца (II) | Pb(OH)2 | 
| 
|
Таблица 6
Стандартные электродные потенциалы (Е) некоторых металлов (ряд напряжений)
| Электрод | φ0, В | Электрод | φ0, В |
| Li +/ Li | -3,045 | Cd2+ /Cd | -0,403 |
| Rb+/Rb | -2,925 | Co2+/Co | -0,277 |
| К+/К | -2,924 | Ni2+/Ni | -0,25 |
| Cs+/Cs | -2,923 | Sn2+/Sn | -0,136 |
| Ва2+/Ва | -2,90 | Pb2+/Pb | -0,127 |
| Са2+/Са | -2,87 | Fe3+/Fe | -0,037 |
| Na+/Na | -2, 714 | 2H+/H | 0,000 |
| Mg2+/Mg | -2,37 | Sb3+/Sb | +0,20 |
| Al3+/Al | -1,70 | Bi3+ /Bi | +0,215 |
| Тi2+/Ti | -1,603 | Cu2+/Cu | +0,34 |
| Zr4+/Zr | -1,58 | Cu+/Cu | +0,52 |
| Mn2+/Mn | -1,18 | Hg2+/2Hg | +0,79 |
| V2+/V | -1,18 | Ag+/Ag | +0,80 |
| Cr2+/Cr | -0,913 | Hg2+/Hg | +0 85 |
| Zn2+/Zn | -0,753 | Pt2+/Pt | +1,19 |
| Cr3+/Cr | -0,74 | Au3+/Au | +1,50 |
| Fe2+/Fe | -0,44 | Au+/Au | +1,70 |
Таблица 7
Последовательность катодных процессов при электролизе
водных растворов электролитов
| Положение металла в ряду напряжений | Li…….…Al (Ti) | Mn…. Cd(Co) | Ni…..Au |
| Катион металла (Меn+) | Li+……Al3+(Ti3+) | Mn2+…Cd2+(Co2+) | Ni2+….. Au+ |
| Процесс на катоде | 2H20+2ē = Н2+20Н-(*) | ←оба процесса→ одновременно | Меn+ +nē=Me |
(*)Потенциал процесса восстановления водорода зависит от концентрации ионов Н + и в случае нейтральных растворов (рН=7) имеет значение φ° = -0,059·7 =-0,41 В, поэтому при электролизе растворов активных металлов (Ti и левее) на катоде восстанавливается водород, при электролизе растворов малоактивных металлов (Ni и правее) на катоде восстанавливается металл, при электролизе растворов металлов средней активности, стоящих в ряду напряжений от Мn до Со, на катоде восстанавливаются и катионы металла и водород. Указанные в таблице границы могут смещаться в ту или иную сторону, при изменении условий (концентрация, температура, плотность тока и т.д).
Таблица 8
Последовательность анодных процессов при электролизе водных растворов электролитов
| Процесс на аноде | φ°, В |
| 40Н- - 4ē = 02 + 2Н20 (щелочь) | 0,4 |
| 2I- - 2ē = l2 | 0,54 |
| 2Вг- -2ē = Вг2 | 1,09 |
| 2Сl - -2ē = Сl2 | 1,36 |
| 2Н20 – 4ē = 02 + 4Н+ | 1,36(*) |
| Кислородсодержащие кислотные остатки в высшей с.о. элементов | φ°разл (Н20) |
| 2F- - 2ē = F2 | 2,37 |
(*) В водных растворах Сl- - содержащих ионов, на аноде выделяется хлор, а не 02. Это обусловлено значительным перенапряжением процесса кислородной деполяризации молекул воды на материале анода.
Таблица 9
Растворимость ионных соединений в воде
| Соединение | Ион | Растворимые | Малорастворимые |
| Сильные основания (щелочи) | OH- | LiOH, NaOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2 | Все остальные |
| Нитраты | NO3- | Все | Нет |
| Перхлораты | ClO4- | Все | Нет |
| Ацетаты | CH3COO- | Все | Нет |
| Хлораты | ClO3- | Все | Нет |
| Хлориды | Cl- | Все, кроме | AgCl, PbCl2, CuCl2 |
| Бромиды | Br- | Все, кроме | AgBr, PbBr2 |
| Иодиды | I- | Все, кроме | AgI |
| Сульфаты | SO42- | Все, кроме | AgSO4, BaSO4 |
| Сульфиды | S2- | (NH4)2S, K2S, Na2S, BaS, CaS | Все остальные |
| Сульфиты | SO32- | (NH4)2SO3, K2SO3, | Все остальные |
| Карбонаты | CO32- | (NH4)2CO3, K2CO3 | Все остальные |
| Фосфаты | PO43- | (NH4)2PO4, K3PO4 | Все остальные |
| Силикаты | SiO32- | (NH4)2SiO3, K2SiO3 | Все остальные |
| Хроматы | CrO42- | (NH4)2CrO4, K2CrO4, Na2CrO4 | Все остальные |
Таблица 10
Варианты контрольных заданий
| Вариант | Контрольное задание | Номера задач | |||||||||
Продолжение таблицы 11
Продолжение таблицы 11
Продолжение таблицы 11
Продолжение таблицы 11
Окончание таблицы 11
Date: 2015-11-13; view: 672; Нарушение авторских прав