
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Гальванический элемент
|
|
(При решении задач этого раздела см. приложение, табл.6.)
Согласно современным представлениям в металле устанавливается равновесие между нейтральными атомами, катионами и электронами, которое можно представить в виде упрощенной схемы
Me ↔ Ме n+ + n  .
.
Если металлическую пластинку опустить в воду, то катионы металла на ее поверхности гидратируются полярными молекулами воды и переходят в жидкость. При этом электроны, в избытке остающиеся в металле, заряжают его поверхностный слой отрицательно. Возникает электростатическое притяжение между перешедшими в жидкость гидратированными катионами и поверхностью металла. В результате в системе устанавливается подвижное равновесие
Me + mH20 ↔ Ме(Н20)n+m + n  ,
,
в растворе на металле
где n - число электронов, принимающих участие в процессе.
На границе металл-жидкость возникает двойной электрический слой, характеризующийся определенным скачком потенциала, названный электродным потенциалом. Его величина зависит от многих факторов (природы металла, концентрации катионов металла, температуры и др.), но измерить абсолютное значение потенциала не удается. На практике обычно определяют относительные электродные потенциалы при стандартных условиях (Р = 105Па, Т=298 К, с=1 моль/дм3) - так называемые стандартные электродные потенциалы (φ°).
Стандартным электродным потенциалом металла называют его равновесный электродный потенциал, возникающий при погружении металла в раствор с концентрацией катиона данного металла, равной 1 моль/дм3, измеренный по сравнению со стандартным водородным электродом, потенциал которого при 298 К условно принимается равным нулю (φ ° = 0; ∆G ° = 0).
Располагая символы металлов в ряд по мере возрастания стандартных электродных потенциалов (φ°) металлов, получаем так называемый ряд напряжений (см. приложение, табл.6).
Местоположение символа того или иного металла в ряду напряжений характеризует восстановительную способность металла, а также окислительные свойства его ионов в водных растворах при стандартных условиях. Чем меньше значение φ°, тем большими восстановительными способностями обладает данный металл в виде простого вещества и тем меньшие окислительные способности проявляют его ионы, и наоборот.
Электродные потенциалы измеряют при помощи гальванических элементов.
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ - УСТРОЙСТВО ДЛЯ ПРЕВРАЩЕНИЯ ЭНЕРГИИ ХИМИЧЕСКОЙ РЕАКЦИИ ОКИСЛЕНИЯ-ВОССТАНОВЛЕНИЯ В ЭЛЕКТРИЧЕСКУЮ.
Действие большинства гальванических элементов основано на реакциях вытеснения металлов из растворов их солей другими металлами. Для работы гальванического элемента является обязательным создание условий, при которых передача электронов от атомов одного металла к ионам другого осуществлялась бы не непосредственно, а через металлический проводник. Таким образом, гальванический элемент представляет собой систему как минимум из двух электродов, соединенных металлическим проводником. Если электроды изготовлены из различных металлов, то гальванический элемент называют биметаллическим. Более активный металл (с меньшим значением φ°) служит анодом. Анод при замыкании цепи окисляется и служит источником электронов, переходящих по цепи к менее активному металлу - катоду, на поверхности которого идет восстановление каких-либо других ионов, находящихся в катодном пространстве. Аноду в гальваническом элементе присваивают отрицательный заряд (источник электронов), катоду - положительный (потребление электронов для восстановления).
Условно схема гальванического элемента изображается следующим образом
(-) А | анодный раствор || катодный раствор | К (+).
Одна вертикальная черта означает изменение фазы, двойная - наличие пористой перегородки или солевого мостика между двумя растворами. Например, схема медно-цинкового гальванического элемента
(-) A Zn | ZnS04 || CuS04 | Сu К (+).
При его работе цинковая пластина окисляется, ионы цинка переходят в анодное пространство, а электроны от цинка, подойдя к медной пластине, восстанавливают ионы меди
Анод: Zn - 2 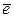 = Zn2+ 1 (окисление)
= Zn2+ 1 (окисление)
катод: Сu 2+ + 2 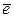 = Сu 1 (восстановление)
= Сu 1 (восстановление)
_____________________________________________
Суммарный процесс: Zn + Cu2+ = Сu + Zn2+
Энергия этой окислительно-восстановительной реакции превращается в электрическую.
Важнейшей характеристикой гальванического элемента является электродвижущая сила (ЭДС) - разность электродных потенциалов катода и анода при разомкнутой цепи. Для медно-цинкового гальванического элемента:
ЭДС =φ°(Cu2+/Cu) - φ°(Zn2+/Zn)= 0,34-(-0,76) = 1,1 В.
Если пластины, изготовленные из одного и того же металла, погружают в растворы одного и того же электролита, но с разной концентрацией в анодном и катодном пространствах, то гальванический элемент называют КОНЦЕНТРАЦИОННЫМ. Анодом в этом случае служит пластина, погруженная в расгвор электролита с меньшей концентрацией (С1), катодом - раствор с большей концентрацией (С2), тогда
ЭДС= φс2 – φс1,
где φ С2 - величина потенциала катода;
φ C1 - величина потенциала анода.
Расчет φ проводят по уравнению Нернста
φ = φ 0 + 0,059/n ·lgC,
где n - число электронов, затраченных на восстановление или полученных при окислении соответствующих ионов.
Date: 2015-11-13; view: 600; Нарушение авторских прав