
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

РЕШЕНИЕ. Степень окисления азота в NH3 - (-3) - низшая, в HN02 - +3 - промежуточная, b HN03 - +5 - высшая; серы в H2S - (-2) - низшая
|
|
Степень окисления азота в NH3 - (-3) - низшая, в HN02 - +3 - промежуточная, b HN03 - +5 - высшая; серы в H2S - (-2) - низшая, в H2SО3 - +4 - промежуточная, в H2S04 - +6 - высшая; марганца в Мn02 - +4 - промежуточная, в КМn04 - +7 - высшая.
Отсюда: NH3, H2S - только восстановители; KMn04, HN03, H2S04- только окислители; H2S03, HN02, Мn02 - окислители и восстановители.
Важнейшими окислителями в окислительно-восстановительных реакциях являются: F2 , 02, 03, H202 ,Сl2, НСlO, НСlOз, H2SO4 (конц), HN03 ,"царская водка" (смесь концентрированных HN03 и HCl), N02, KMn04 , Mn02 , К2Сr207, Cr03, Pb02 и другие.
Слабые окислители: I2, бромная вода (Вr2 + Н20), S02, HN02 , Fe 3+ и другие.
Сильные восстановительные свойства проявляют: щелочные и щелочно-земельные металлы, Мg, Аl, Н2 (особенно в момент выделения), НI и иодиды, НВr и бромиды, H2S и сульфиды, NH3, РНз, Н3Р04, С, CO, Fe2+, Сr2+ и др.
Слабые восстановители: малоактивные металлы (Рb, Сu, Аg, Hg), HCl и хлориды, S02, HN02 и др.
Если в уравнении продукты реакции не даны, необходимо их вывести, пользуясь таблицами характерных степеней окисления (табл. 3.1 и 3.2) и знаниями свойств соединений конкретных химических элементов.
Если новая степень окисления элемента - положительна, то для вывода формулы продукта необходимо составить следующую цепочку формул соединений этого элемента
Э+n 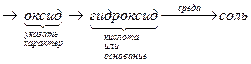
Например,
а) А1+3 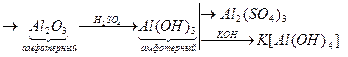
Для вывода продукта реакции важно взаимодействие оксида или гидроксида со средой. Так как гидроксид алюминия - амфотерный, то в кислой среде (например, H2SO4) продуктом будет сульфат алюминия, а в щелочной (КОН) - алюминат K[Al(OH4)].
б) S+6 
Формула среды может находиться только в одной части уравнения. Если выведенная формула продукта совпадает с формулой среды (H2S04), то при наличии в растворе ионов К+ или Na+ продуктом будет соль серной кислоты, например Na2S04.
в) Fе+3 
В щелочной среде продуктом будет гидроксид Fe(OH)3.
г) С+4 
В кислой среде растворение С02 в воде затруднено, поэтому продуктом будетуглекислый газ (СО2).
Если новая степень окисления элемента отрицательна, то цепочка для вывода формулы продукта должна быть следующей

Например,
а) Сl-1 
б) 
При выводе продуктов окислительно-восстановительных реакций необходимо учитывать особенности поведения конкретных химических элементов. Так, марганец меняет свою степень окисления по-разному, в зависимости от среды. Мn+7 понижает свою степень окисления: в кислой среде до +2, в нейтральной - до +4, в сильно щелочной - до +6. Мn+2 повышает степень окисления: в кислой среде - до +7, в нейтральной - до +4 и в щелочной - до +6.
При выводе продуктов соединений хрома (VI) следует помнить, что в щелочной среде устойчивы хроматы, а в кислой - дихроматы

Элементы с отрицательной степенью окисления обычно меняют ее в результате реакции на нулевую. Продуктом реакции в этом случае является простое вещество (Cl2 , S, I2 и др.).
Например
а) 2Сl-1-2 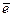 = Сl2;
= Сl2;
б) S-2-2 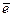 =S;
=S;
в) 2I-1 - 2 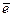 = I 2 (в кислой среде).
= I 2 (в кислой среде).
Исключением является иодид-ион I-1 в щелочнойсреде,так какI 2 в щелочной среде неустойчив:
I-1 - 6 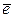 = I+5 (в щелочной среде).
= I+5 (в щелочной среде).
Формулы остальных продуктов получают, объединяя оставшиеся ионы cионами среды.
Рассмотренный выше способ вывода продуктов применим лишь для окиcлительно-восстановительных реакций в растворах; продукты реакций в газовой фазе и в расплавах находят, пользуясь справочной литературой.
Date: 2015-11-13; view: 648; Нарушение авторских прав