
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Примеры решения задач. Пример 1. Вода подается в фонтан из большого цилиндрического бака (рис
|
|
Пример 1. Вода подается в фонтан из большого цилиндрического бака (рис. 19) и бьет из отверстия II—II со скоростью v2= 12 м/с. Диаметр D бака равен 2м, диаметр d сечения II—II равен 2 см. Найти: 1) скорость v1 понижения воды в баке; 2) давление p1, под которым вода подается в фонтан; 3) высоту h1 уровня воды в баке и высоту h2 струи, выходящей из фонтана.
 Решение. 1. Проведем сечение I—I в баке на уровне сечения II—II фонтана. Так как площадь S1 сечения I—I много больше площади S2 (рис. 19) сечения II—II, то высоту h1 уровня воды вбакеможно считать длямалого промежутка времени постоянной, а поток – установившимся. Для установившегося потока справедливо условие неразрывности струи: v1S1 = v2S2 откуда v1 = v2S2 / S1, или
Решение. 1. Проведем сечение I—I в баке на уровне сечения II—II фонтана. Так как площадь S1 сечения I—I много больше площади S2 (рис. 19) сечения II—II, то высоту h1 уровня воды вбакеможно считать длямалого промежутка времени постоянной, а поток – установившимся. Для установившегося потока справедливо условие неразрывности струи: v1S1 = v2S2 откуда v1 = v2S2 / S1, или
v1 = v2 (d/D) 2. (1)
Подставив значения заданных величин в (1) и произведя вычисления, найдем
v 1=0,0012 м/с.
С такой же скоростью будет понижаться уровень в баке. Как видно, эта скорость очень мала по сравнению со скоростью струи.
2. Давление p 1, под которым вода подается в фонтан, найдем по уравнению Бернулли. В случае горизонтальной трубки тока оно имеет вид
 . (2)
. (2)
Учтя, что p2 =0 (под давлением подразумевается избыточное над атмосферным давление), из уравнения (2) получим
 . (3)
. (3)
Так как v1 << v2, то из равенства (3) следует
 .
.
После вычислений, произведенных по этой формуле, найдем
p 1 = 72 кПа.
3. Высоту h1 уровня воды в баке найдем из соотношения  , откуда
, откуда
 .
.
Произведя вычисления по этой формуле, найдем
h 1=7,35 м.
Зная скорость v2, с которой вода выбрасывается фонтаном, найдем высоту h2, на которую она будет выброшена:
 =7,35 м.
=7,35 м.
Подчеркнем, что высота уровня воды в баке равна высоте, на которую поднимается фонтан воды (по правилу сообщающихся сосудов). Это замечание справедливо, если пренебречь сопротивлением воздуха.
Пример 2. В сосуде с глицерином падает свинцовый шарик. Определить максимальное значение диаметра шарика, при котором движение слоев глицерина, вызванное падением шарика, является еще ламинарным. Движение считать установившимся.
Решение. Если в вязкой жидкости движется тело, то вместе с ним, как одно целое, движется и прилипший к телу слой жидкости. Этот слой вследствие внутреннего трения увлекает за собой и соседние слои. Возникающее при этом движение жидкости является ламинарным или турбулентным в зависимости от размеров, формы тела и его скорости. Характер движения зависит также от свойств жидкости и определяется безразмерным числом Рейнольдса.
Если тело, движущееся в жидкости, имеет форму шара диаметром d, то число Рейнольдса определяется по формуле
 , (1)
, (1)
а критическое значение этого числа Re кр =0,5.
Скорость v выразим, исходя из следующих соображений. На свинцовый шарик, падающий в глицерине, действуют три силы:
1) сила тяжести шарика
 ,
,
где  св — плотность свинца; V— объем шарика;
св — плотность свинца; V— объем шарика;
2) выталкивающая сила, определяемая по закону Архимеда
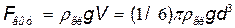 ,
,
где  гл —плотность глицерина;
гл —плотность глицерина;
3) сила внутреннего трения, определяемая по формуле Стокса,
 .
.
При установившемся движении шарика в жидкости (v =const) сила тяжести шарика уравновешивается суммой выталкивающей силы и силы внутреннего трения, т. е.
 ,
,
откуда
 (2)
(2)
Решая совместно уравнения (1) и (2) относительно d, найдем
 .
.
Максимальное значение диаметра dmax при котором движение остается еще ламинарным, соответствует критическому значению числа Рейнольдса Re кp. Поэтому
 .
.
Подставив сюда значения величин h = 1,48 Па·с; Re кp =0,5;  cв =11300 кг/м3;
cв =11300 кг/м3;  гл =1260 кг/м3 и произведя вычисления, получим
гл =1260 кг/м3 и произведя вычисления, получим
dmax =5,29 мм.
Пример 3. Верхний конец стального стержня длиной l = 5 м с площадью поперечного сечения S = 4 см2 закреплен неподвижно, к нижнему подвешен груз массой  кг. Определить: 1) нормальное напряжение
кг. Определить: 1) нормальное напряжение  материала стержня; 2) абсолютное х и относительное ε удлинения стержня; 3) потенциальную энергию
материала стержня; 2) абсолютное х и относительное ε удлинения стержня; 3) потенциальную энергию  растянутого стержня.
растянутого стержня.
Решение. 1. Нормальное напряжение материала растянутого стержня выражается формулой  , где F — сила, действующая вдоль оси стержня. В данном случае F равна силе тяжести mg и поэтому можем записать
, где F — сила, действующая вдоль оси стержня. В данном случае F равна силе тяжести mg и поэтому можем записать
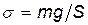 .
.
Сделав вычисления, найдем
 МПа.
МПа.
2. Абсолютное удлинение выражается формулой
 ,
,
где Е — модуль Юнга.
Подставив значения величин F, l, S и Е в эту формулу (значение  Па из справочных данных) и произведя вычисления, получим
Па из справочных данных) и произведя вычисления, получим
 .
.
Относительное удлинение стержня
 =2,46·10-4.
=2,46·10-4.
3. Потенциальная энергия растянутого стержня  ,
,
где V — объем тела, равный S × l.
Выполнив вычисления по этой формуле, получим
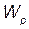 = 12,1 Дж.
= 12,1 Дж.
Пример 4. Найти молярную массу М смеси кислорода массой m 1=25 г и азота массой m 2=75 г.
Решение. Молярная масса смеси М см есть отношение массы смеси т см к количеству вещества смеси  см т. е.
см т. е.
 . (1)
. (1)
Масса смеси равна сумме масс компонентов смеси m см= m 1+ m 2. Количество вещества смеси равно сумме количеств вещества компонентов.
Подставив в формулу (1) выражения m см и  см, получим
см, получим
 . (2)
. (2)
Молярные массы M 1 кислорода и М 2 азота:
M 1 =32×10-3 кг/моль, М 2=28×10-3 кг/моль. Подставим значения величин в (2) и произведем вычисления:

Пример 5. Определить: 1) число N молекул воды, занимающей при температуре t= 4°C объем V = 1 мм3; 2) массу m 1 молекулы воды; 3) диаметр d молекулы воды, считая, что молекулы имеют форму шариков, соприкасающихся друг с другом.
Решение. 1. Число N молекул, содержащихся в теле некоторой массы m, равно произведению постоянной Авогадро n a на количество вещества  :
:  . Так как
. Так как  , где М — молярная масса, то
, где М — молярная масса, то  . Выразив в этой формуле массу как произведение плотности r на объем V, получим
. Выразив в этой формуле массу как произведение плотности r на объем V, получим
 . (1)
. (1)
Все величины, кроме молярной массы воды, входящие в (1), известны: r =l×103 кг/м3, V =1 мм3=1×10-9 м3, n a=6,02×1023 моль-1.
Зная химическую формулу воды (Н2О), найдем молярную массу воды:
M= M r k= (2×1+1×16)×10-3 кг/моль=18×10-3 кг/моль. Подставим значения величин в (1) и произведем вычисления:
N= [1×103×1×10-9/(18×10-3)] 6,02×1023 молекул=3,34·1019 молекул.
2. Массу одной молекулы воды найдем делением ее молярной массы на постоянную Авогадро: m 1= M / n a. Произведя вычисления по этой формуле, получим
 .
.
3. Будем считать, что молекулы плотно прилегают друг к другу, тогда на каждую молекулу диаметром d приходится объем (кубическая ячейка) V 1= d 3. Отсюда
 . (2)
. (2)
Объем V 1 найдем, разделив молярный объем V m вещества на число молекул в моле, т. е.на постоянную Авогадро n a: V 1= V m/ n a. Молярный объем равен отношению молярной массы к плотности вещества, т. е. V m= M / r. Поэтому можем записать, что V 1= M /(rn a).Подставив полученное выражение V 1 в формулу (2), получим
 . (3)
. (3)
Проверим, дает ли правая часть выражения (3) единицу длины:
 .
.
Теперь подставим значения величин в формулу (3) и произведем вычисления:
d =3,11×10-10 м=311 пм.
Пример 6. В баллоне объемом V = 10 л находится гелий под давлением  =1 МПа при температуре T 1=300 К. После того как из баллона был израсходован гелий массой m =10 г, температура в баллоне понизилась до T 2=290 К. Определить давление
=1 МПа при температуре T 1=300 К. После того как из баллона был израсходован гелий массой m =10 г, температура в баллоне понизилась до T 2=290 К. Определить давление  гелия, оставшегося в баллоне.
гелия, оставшегося в баллоне.
Решение. Для решения задачи воспользуемся уравнением Клапейрона – Менделеева, применив его дважды к начальному и конечному состояниям газа. Для начального состояния уравнение имеет вид
p 1 V =(m 1/ M) RT 1, (1)
а для конечного состояния –
p 2 V =(m 2/ M) RT 2, (2)
где m 1 и m 2 — массы гелия в начальном и конечном состояниях.
Выразим массы m 1 и m 2 гелия из уравнений (1) и (2):
m 1= Mp1V /(RT 1); (3)
m2=Mp2V/(RT2); (4)
Вычитая из (3) равенство (4), получим
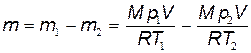 .
.
Отсюда найдем искомое давление:
 . (5)
. (5)
Проверим, дает ли правая часть формулы (5) единицу давления. Для этого выразим все величины, входящие в нее, в соответствующих единицах. Единица, в которой выражается первое слагаемое, не вызывает сомнений, так как отношение T 2/ T 1 — величина безразмерная. Проверим, в каких единицах выражается второе слагаемое:

Убедившись в том, что правая часть полученной расчетной формулы дает единицу искомой величины – давления, можем подставить в (5) значения всех величин и произвести вычисления.
В формуле (5) все величины, кроме молярной массы М гелия, известны. Для гелия как одноатомного газа относительная молекулярная масса равна его относительной атомной массе А r.
Из таблицы Д. И. Менделеева найдем А r=4. Следовательно, молярная масса гелия М= А r×10-3 кг/моль =4×10-3 кг/моль. Подставив значения величин в (5), получим
 .
.
Пример 7. Определить количество теплоты, поглощаемой водородом массой m =0,2 кг при нагревании его от температуры t 1=0°С до температуры t 2=100 °С при постоянном давлении. Найти также изменение внутренней энергии газа и совершаемую им работу.
Решение. Количество теплоты Q, поглощаемое газом при изобарном нагревании, определяется по формуле
Q=mcpDT, (1)
где m — масса нагреваемого газа; cp — его удельная теплоемкость при постоянном давлении; D T — изменение температуры газа.
Как известно,  . Подставив это выражение c p в формулу (1), получим
. Подставив это выражение c p в формулу (1), получим
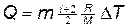 ,
,
где  (молекула водорода двухатомная);
(молекула водорода двухатомная);  кг/моль – молярная масса водорода.
кг/моль – молярная масса водорода.
Произведя вычисления по этой формуле, найдем
Q =291 кДж.
Внутренняя энергия выражается формулой  , следовательно, изменение внутренней энергии
, следовательно, изменение внутренней энергии
 .
.
После подстановки в эту формулу числовых значений величин и вычислений получим DU =208 кДж.
 Работу расширения газа определим по формуле, выражающей первое начало термодинамики: Q=DU+A, откуда
Работу расширения газа определим по формуле, выражающей первое начало термодинамики: Q=DU+A, откуда
A=Q – DU.
Подставив значения Q и DU, найдем
А =83 кДж.
Пример 8. Кислород занимает объем V 1=1 м3 и находится под давлением р 1=200 кПа. Газ нагрели сначала при постоянном давлении до объема V 2=3 м3, a затем при постоянном объеме до давления (рис 20) р 2=500 кПа. Построить график процесса и найти: 1) изменение DU внутренней энергии газа; 2) совершенную им работу A; 3) количество теплоты Q,переданное газу.
 Решение. Построим график процесса (рис. 20). На графике точками 1, 2, 3 обозначены состояния газа, характеризуемые параметрами (р 1, V 1, T 1), (р 1, V 2, T 2),(р 2, V 2, T 3).
Решение. Построим график процесса (рис. 20). На графике точками 1, 2, 3 обозначены состояния газа, характеризуемые параметрами (р 1, V 1, T 1), (р 1, V 2, T 2),(р 2, V 2, T 3).
1. Изменение внутренней энергии газа при переходе его из состояния 1 в состояние 3 выражается формулой
DU=cvmDT,
где c v — удельная теплоемкость газа при постоянном объеме; m — масса газа; D T — разность температур, соответствующих конечному 3и начальному 1 состояниям, т. е. D T = T 3 – T 1. Так как  ;
;
где М — молярная масса газа, то
 . (1)
. (1)
Температуры T 1 и T 3 выразим из уравнения Менделеева — Клапейрона ( ):
):

С учетом этого равенство (1) перепишем в виде
DU=(i/2)(p2V2 – p1V1).
Подставим сюда значения величин (учтем, что для кислорода, как двухатомного газа, i =5) и произведем вычисления:
DU=3,25 МДж.
2. Полная работа, совершаемая газом, равна A = A 1+ A 2, где A 1 — работа на участке 1—2; A 2 — работа на участке 2—3,
На участке 1—2 давление постоянно (p =const). Работа в этом случае выражается формулой A 1= p 1D V = p 1(V 2 – V 1). На участке 2—3 объем газа не изменяется и, следовательно, работа газа на этом участке равна нулю (A 2=0). Таким образом,
A=A1=p1(V2—V1).
Подставив в эту формулу значения физических величин, произведем вычисления:
A=0,4 МДж
 3. Согласно первому началу термодинамики, количество теплоты Q, переданное газу, равно сумме работы A, совершенной газом, и изменению D U внутренней энергии:
3. Согласно первому началу термодинамики, количество теплоты Q, переданное газу, равно сумме работы A, совершенной газом, и изменению D U внутренней энергии:
Q=A+DU, или Q =3,65 МДж.
Пример 9. Идеальный двухатомный газ, содержащий количество вещества  =l моль, находится под давлением p 1=250кПа и занимает объем V 1==10 л. Сначала газ изохорно нагревают до температуры T 2=400 К. Далее, изотермически расширяя, доводят его до первоначального давления. После этого путем изобарного сжатия возвращают газ в начальное состояние. Определить термический КПД h цикла.
=l моль, находится под давлением p 1=250кПа и занимает объем V 1==10 л. Сначала газ изохорно нагревают до температуры T 2=400 К. Далее, изотермически расширяя, доводят его до первоначального давления. После этого путем изобарного сжатия возвращают газ в начальное состояние. Определить термический КПД h цикла.
Решение. Для наглядности построим сначала график цикла, который состоит из изохоры, изотермы и изобары. В координатах р, V этот цикл имеет вид. представленный на рис. 21. Характерные точки цикла обозначим 1, 2, 3.
Термический КПД любого цикла определяется выражением
h=(Q1 – Q2)/Q1, или h =1 – Q2/Q1, (1)
 где Q 1 — количество теплоты, полученное газом за цикл от нагревателя; Q 2 — количество теплоты, отданное газом за цикл охладителю.
где Q 1 — количество теплоты, полученное газом за цикл от нагревателя; Q 2 — количество теплоты, отданное газом за цикл охладителю.
Заметим, что разность количеств теплоты Q 1 – Q 2 равна работе A, совершаемой газом за цикл. Эта работа на графике в координатах р, V (рис. 21) изображается площадью цикла (площадь цикла заштрихована).
Рабочее вещество (газ) получает количество теплоты Q 1 на двух участках: Q 1-2 на участке 1—2 (изохорный процесс) и Q 2-3 на участке 2—3 (изотермический процесс). Таким образом,
Q1=Q1-2+Q2-3.
Количество теплоты, полученное газом при изохорном процессе, равно
Q1-2= C v  (T 2 – T 1),
(T 2 – T 1),
где C v — молярная теплоемкость газа при постоянном объеме;  — количество вещества. Температуру T 1 начального состояния газа найдем, воспользовавшись уравнением Клапейрона — Менделеева:
— количество вещества. Температуру T 1 начального состояния газа найдем, воспользовавшись уравнением Клапейрона — Менделеева:
T1=p1V1/( R).
R).
Подставив числовые значения и произведя вычисления, получим
 .
.
Количество теплоты, полученное газом при изотермическом процессе, равно
Q 2-3=  RT 2ln(V 2/ V 1),
RT 2ln(V 2/ V 1),
где V 2 — объем, занимаемый газом при температуре T 2 и давлении p 1 (точка 3 на графике).
На участке 3—1 газ отдает количество теплоты Q 2, равное
Q 2= Q 3-1= Cp  (T 2 – T 1),
(T 2 – T 1),
где Cp — молярная теплоемкость газа при изобарном процессе.
Подставим найденные значения Q 1 и Q 2 в формулу (1):

В полученном выражении заменим отношение объемов V 2/ V 1, согласно закону Гей-Люссака, отношением температур (V 2/ V 1= T 2/ T 1) и зная C v и Cp для двухатомного газа [ C v=5 R /2, C p =7 R /2]. Тогда после сокращения на  и R /2получим
и R /2получим
 .
.
Подставив значения T 1, T 2 и R и произведя вычисления, найдем
 .
.
Пример 10. В цилиндре под поршнем находится водород массой m =0,02 кг при температуре T 1=300K. Водород начал расширяться адиабатно, увеличив свой объем в пять раз, а затем был сжат изотермически, причем объем газа уменьшился в пять раз. Найти температуру Т 2, в конце адиабатного расширения и работу А, совершенную газом. Изобразить процесс графически.
Решение. Температуры и объемы газа, совершающего адиабатный процесс, связаны между собой соотношением
 ,
,
где g — показатель адиабаты (для водорода как двухатомного газа g =1,4).
Отсюда получаем выражение для конечной температуры T 2:
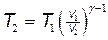 .
.
Подставляя числовые значения заданных величин, находим
 .
.
Работа A 1 газа при адиабатном расширении определяется по формуле
 .
.
Подставив сюда числовые значения величин, после вычисления получим
 .
.
Работа A 2 газа при изотермическом сжатии выражается формулой
 A2=RT2(m/M)ln(V1/V2).
A2=RT2(m/M)ln(V1/V2).
Произведя вычисления по этой формуле, найдем
A 2= – 21 кДж.
Знак минус показывает, что при сжатии газа работа совершена внешними силами.
 Общая работа, совершенная газом при рассмотренных процессах, А = A 1+ A 2=29,8кДж + (–21 кДж) =8,8 кДж.
Общая работа, совершенная газом при рассмотренных процессах, А = A 1+ A 2=29,8кДж + (–21 кДж) =8,8 кДж.
График процесса приведен на рис. 22.
Пример 11. Нагреватель тепловой машины, работающей по обратимому циклу Карно, имеет температуру t 1=200°С. Определить температуру Т 2, охладителя, если при получении от нагревателя количества теплоты Q 1= 1 Дж машина совершает работу A=0,4 Дж? Потери на трение и теплоотдачу не учитывать.
Решение. Температуру охладителя найдем, использовав выражение для термического КПД машины, работающей по циклу Карно, h =(T 1 – T 2)/ T 1. Отсюда
T 2 = T 1(1 – h). (1)
Термический КПД тепловой машины выражает отношение количества теплоты, которое превращено в механическую работу A, к количеству теплоты Q 1, которое получено рабочим телом тепловой машины из внешней среды (от нагревателя), т. е. h = A/Q 1. Подставив это выражение в формулу (1), найдем
T 2= T 1(1 – A/Q). (2)
Учтя, что T 1=473 К, после вычисления по формуле (2) получим T 2=284 К.
Пример 12. Найти изменение D S энтропии при нагревании воды массой m =100 г от температуры t 1=0°C до температуры t 2=100 °С и последующем превращении воды в пар той же температуры.
Решение. Найдем отдельно изменение энтропии D S ' при нагревании воды и изменение энтропии D S " при превращении ее в пар. Полное изменение энтропии выразится суммой D S ' и D S ".
Как известно, изменение энтропии выражается общей формулой
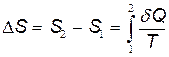 (1)
(1)
При бесконечно малом изменении dT температуры нагреваемого тела затрачивается количество теплоты  , где m — масса тела; с — его удельная теплоемкость. Подставив выражение
, где m — масса тела; с — его удельная теплоемкость. Подставив выражение  в равенство (1), найдем формулу для вычисления изменения энтропии при нагревании воды:
в равенство (1), найдем формулу для вычисления изменения энтропии при нагревании воды:
.
Вынесем за знак интеграла постоянные величины и произведем интегрирование, тогда получим
D S '= mc· ln(T 2/ T 1).
После вычислений найдем D S '=132 Дж/К.
При вычислении по формуле (1) изменения энтропии во время превращения воды в пар той же температуры постоянная температуpa T выносится за знак интеграла. Вычислив интеграл, найдем
 (2)
(2)
где Q — количество теплоты, переданное при превращении нагретой воды в пар той же температуры.
Подставив в равенство (2) выражение количества теплоты Q=lm, где l — удельная теплота парообразования, получим
 . (3)
. (3)
Произведя вычисления по формуле (3), найдем
D S "=605 Дж/К.
Полное изменение энтропии при нагревании воды и последующем превращении ее в пар D S =D S '+D S "=737 Дж/К.
Пример 13. Определить изменение D S энтропии при изотермическом расширении кислорода массой m =10 г от объема V 1=25 л до объема V 2=100 л.
Решение. Так как процесс изотермический, то в общем выражении энтропии 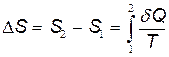 температуру выносят за знак интеграла. Выполнив это, получим
температуру выносят за знак интеграла. Выполнив это, получим
 (1)
(1)
Количество теплоты Q, полученное газом, найдем по первому началу термодинамики: Q=DU+A. Для изотермического процесса DU =0, следовательно,
Q=A, (2)
а работа А для этого процесса определяется по формуле
A=(m/M)RT ln(V2/V1). (3)
С учетом (2) и (3) равенство (1) примет вид
D S = ( m / M) R ln(V 2/ V 1). (4)
Подставив в (4) числовые значения и произведя вычисления, получим
D S =(10×10-3/(32×10-3)) ×8,31 ln(100×10-3 / (25×10-3)) Дж/К=3,60 Дж/К.
Таблица вариантов
Date: 2015-12-10; view: 472; Нарушение авторских прав