
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Молярная масса вещества
|
|
 ,
,
где m— масса однородного тела (системы); n—количество вещества (число молей) этого тела (системы). Выражается в единицах г/моль (или кг/моль).
Единица массы, равная 1/12 массы атома углерода 12C, называется атомной единицей массы (а.е.м.). Массы атомов или молекул выраженные в атомных единицах массы называют соответственно относительной атомной или относительной молекулярной массой вещества. Относительная молекулярная масса вещества состоит из относительных атомных масс химических элементов, составляющих молекулу вещества. Относительные атомные массы химических элементов приводятся в таблице Д. И. Менделеева (см. также таблицу 8 приложения данного пособия).
Молярная масса вещества численно равна относительной атомной или молекулярной массе данного вещества, если размерность а.е.м. заменить на размерность г/моль.
Количество вещества смеси n газов
 или
или  ,
,
где ν i, Ni, mi, m i — соответственно количество вещества, число молекул, масса и молярная масса i -го компонента смеси (i =1,2,…, n).
Уравнение Менделеева — Клапейрона (уравнение состояния идеального газа)
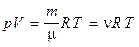 ,
,
где т — масса газа, m — молярная масса газа, R — универсальная газовая постоянная, ν — количество вещества, Т — термодинамическая температура.
Опытные газовые законы, являющиеся частными случаями уравнения Менделеева — Клапейрона для изопроцессов:
а) закон Бойля—Мариотта (изотермический процесс: T =const, m =const)

или для двух состояний газа, обозначенных цифрами 1 и 2,
 ,
,
б) закон Гей-Люссака (изобарический процесс: р =const, m =const)
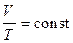 или для двух состояний
или для двух состояний  ,
,
в) закон Шарля (изохорический процесс: V =const, m =const)
 или для двух состояний
или для двух состояний 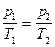 ,
,
г) объединенный газовый закон (m =const)
 или для двух состояний
или для двух состояний 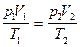 .
.
Под нормальными условиями понимают давление p o=1 атм (1,013 × 105 Па), температуру 0оС (T =273 K).
Закон Дальтона, определяющий давление смеси n газов.
 ,
,
где pi — парциальные давления компонентов смеси (i =1,2,…, n).Парциальным давлением называется давление газа, которое производил бы этот газ, если бы только он один находился в сосуде, занятом смесью.
Молярная масса смеси n газов
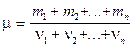 .
.
Массовая доля i -го компонента смеси газа (в долях единицы или процентах)
 ,
,
где т — масса смеси.
Date: 2015-12-10; view: 443; Нарушение авторских прав