
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Определение электрохимического эквивалента меди
|
|
Цель работы: определить электрохимическийэквивалент меди.
Теория. Молекулы солей, кислот, щелочей, при растворении этих веществ, например в воде, распадаются на заряженные частицы - ионы. Процесс называется электролитической диссоциацией.
Если в раствор, содержащий ионы, опустить пластины, соединенные с зажимами источника постоянного тока, то в образовавшемся электролитическом поле положительные ионы металла или водорода будут двигаться к отрицательной пластине (катоду) и выделятся на нем в виде твердого осадка (металл) или пузырьков газа (водород). Отрицательные ионы будут выделяться на положительной пластине (аноде). Этот процесс сопровождающий протекание тока через раствор, называется электролизом.
Масса выделившихся ионов m прямо пропорциональна количеству перенесённого ионами электричества q или силе тока I и времени его прохождения t:
m=k I t
Коэффициент пропорциональности k является для каждого вещества величиной постоянной и называется электрохимическим эквивалентом вещества. Он показывает какова масса вещества, выделяющегося на электроде при прохождении через электролит единицы количества электричества.
Приборы и принадлежности: аккумулятор, электролитическая ванна с раствором медного купороса, 2 медных электрода, амперметр постоянного тока, реостат, рубильник, провода, весы, разновесы до 0,01 г, секундомер, электрическая плитка, сосуд с водой.
Порядок выполнения работы:
1. Работа с электрической цепью.
1.1. Собрать цепь, как показано на схеме (рисунок 1.1);
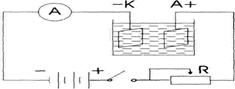
Рисунок 1.1
1.2. Замкнуть цепь и с помощью реостата R установить силу тока около 0,5А; 1.3. Разомкнуть цепь;
2. Вынуть катод, просушить над электрической плиткой, очистить его наждачной бумагой.
2.1. Промыть в воде катод и повторно просушить его над электрической плиткой;
3. Уравновесить весы.
3.1. Взвесить катод и определить массу(m 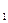 ) с точностью до 10 мг;
) с точностью до 10 мг;
3.2. Поместить катод в электролитическую ванну, замкнуть цепь и одновременно пустить в ход секундомер;
3.3. Во время опыта, который длится 15-20 минут, необходимо следить за тем, чтобы сила тока была неизменной. (0,5 А);
4. Разомкнуть цепь и засечь время в секундах (t,c).
4.1. Извлечь катод из ванны, осторожно промыть в воде, просушить над электрической плиткой;
4.2. Повторно взвесив, определить массу (m  );
);
5. Вычислить электрохимический эквивалент меди по формуле, зная I(А), t(с), m 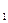 (кг), m
(кг), m  (кг):
(кг): 

6. Повторить опыт, используя пункты 1.2.-5 лабораторной работы.
7. Найти среднее значение электрохимического эквивалента 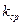 , используя данные 2-х опытов.
, используя данные 2-х опытов.
8. Зная, что табличное значение  , определить относительную погрешность по формуле:
, определить относительную погрешность по формуле:
 , где k
, где k  = k
= k 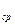 .
.
9. Результаты измерений и вычислений записать в таблицу 9.1.:
Таблица 9.1.
| № п\п | m 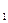 ,
(кг) ,
(кг)
| m  ,
(кг) ,
(кг)
| m 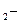 m m 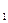 (кг)
(кг) 
| I, (А) | t, (с) | k, (кг/Кл) | k 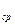 ,
(кг/Кл) ,
(кг/Кл)
| 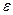 ,
% ,
%
|
10. Сделать вывод о проделанной работе.
11. Ответить на контрольные вопросы.
Контрольные вопросы:
3. Почему молекулы соли, кислоты и щёлочи в воде распадаются на ионы?
4. Почему с повышением температуры сопротивление электролита уменьшается?
5. При каких условиях концентрация электролита в процессе электролиза остаётся постоянной? меняется?
6. Как следует поступить, если по ошибке при выполнении опыта взвешенная пластинка была соединена с положительным полюсом источника тока?
Date: 2015-10-19; view: 2462; Нарушение авторских прав