
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

В водных растворах
|
|
Таблица 8
| Электродный процесс | Е0, В |
| Азот | |
| NO2- +H2O+e = NO+2OH- | -0,46 |
| NO2- + 6H2O + 6e = NH4OH + 7OH- | -0,15 |
| NO3- + 2H2O + 3e = NO + 4OH- | -0,14 |
| NO3- + 7H2O + 8e = NH4OH + 9OH- | -0,12 |
| NO3- + H2O + 2e = NO2- + 2OH- | +0,01 |
| 2NO2- + 4H2O + 6e = N2 + 8OH- | +0,41 |
Продолжение табл. 8
| Электродный процесс | Е0, В |
| 2NO2 + 4H2O + 8e = N2 + 8OH- | +0,53 |
| NО3- + 2H+ + e = NO2 + H2O | +0,78 |
| NО3- + 2H+ + 2e = NO2- + H2O | +0,94 |
| NO3- + 10H+ + 8e = NH4+ + 3H2O | +0,87 |
| NO3- + 4H++ 3e = NO + 2H2O | +0,96 |
| HNO2 + H+ + e = NO + H2O | +1,00 |
| 2NO3- + 10H+ + 8e = N2O + 5H2O | +1,116 |
| 2NO3-+ 12H+ + l0e = N2 + 6H2O | +1,246 |
| 2НNO2 + 4H+ + 4e = N2O + 3H2O | +1,297 |
| 2HNO2 + 6H+ + 6e = N2 + 4H2O | +1,45 |
| Алюминий | |
| AlO2- + 2H2О + 3e = Al + 4ОH- | -2,35 |
| [Al(OH)4]- + 3e = Al + 4ОH- | -2,35 |
| AlF63- + 3e=Al+6F- | -2,07 |
| A13++3e=Al | -1,663 |
| Al(OH)3 + 3H+ + 3e = Al + 3H2O | -1,471 |
| AlO2- + 4H+ + 3e = Al + 2H2O | -1,262 |
| Барий | |
| Ba2++2e=Ba | -2,905 |
| Бериллий | |
| Be2+ + 2e = Be | -1,847 |
| BeO22-+ 4H+ + 2e = Be + 2H2О | -0,909 |
| Бор | |
| BF4- + 3e = B + 4F- | -1,04 |
| H3BO3 + 3H+ + 3e = B + 3H2О | -0,869 |
| BO33- + 6H+ + 3e = B + 3H2О | -0,165 |
| Бром | |
| 2BrO- + 2H2О + 2e = Br2 + 4ОH- | +0,45 |
| 2BrО3- + 6H2О + 10e = Br2 + 12ОH- | +0,5 |
| BrO3- + 2H2О + 4e = BrO- + 4ОH- | +0,54 |
Продолжение табл. 8
| Электродный процесс | Е0, В |
| BrO3- + 3H2О + 6e = Br- + 6ОH- | +0,61 |
| BrO-+ H2О + 2e = Br- + 2ОH- | +0,76 |
| Br2(ж)+ 2e=2Br- | +1,065 |
| BrO3-+ 6H+ + 6e = Br- + 3Н2О | +1,44 |
| HBrO + H+ + 2e = Br- + H2O | +1,34 |
| 2BrО3- + 12H+ + l0e = Br2 + 6H2О | +1,52 |
| 2HBrO + 2H+ + 2e = Br2+ 2Н2О | +1,59 |
| Ванадий | |
| V2+ + 2e = V | -1,175 |
| V3+ + e = V2+ | -0,255 |
| VO2+ + 4H+ + 5e = V + 2H2О | -0,25 |
| VО43- + 6H+ + 2e = VO + + 2H2О | +1,256 |
| Висмут | |
| Bi2О3 + 3H2O + 6e = 2Bi + 6ОH- | -0,46 |
| Bi3+ + 3e = Bi | +0,215 |
| Водород | |
| H2 + 2e = 2H- | -2,251 |
| 2H2О + 2e = H2 + 2ОH- | -0,828 |
| 2H+ + 2e = H2 | 0,000 |
| H2О2 + 2H++ 2e = 2H2О | +1,776 |
| Вольфрам | |
| WО42- + 4H2О + 6e = W + 8ОH- | -1,05 |
| WО42- + 8H+ + 6e = W + 4H2О | +0,049 |
| 2WО42- + 6Н+ + 2e = W2О5 + 3Н2О | +0,801 |
| Германий | |
| H2GeO3 + 4H+ + 4e = Ge + 3H2О | -0,13 |
| Ge2+ + 2e = Ge | ≈0,000 |
| Железо | |
| Fe(OH)3 + e = Fe(OH)2 + OH- | -0,56 |
| Fe2+ + 2e = Fe | -0,44 |
| Fe3+ + 3e = Fe | -0,037 |
| Fe(OH)3 + H+ + e = Fe(OH)2 + H2О | +0,271 |
Продолжение табл. 8
| Электродный процесс | Е0, В |
| Fe(CN)63- +e=Fe(CN)64- | +0,356 |
| FeО42- + 4Н2О + 3e = Fe(OH)3 + 5ОH- | +0,72 |
| Fe3+ +e=Fe2+ | +0,771 |
| FeО42- + 8H+ + 3e = Fe3+ + 4H2О | +1,7 |
| Золото | |
| Au(CN)2- + e = Au + 2CN- | -0,61 |
| Au3+ + 2e = Au+ | +1,401 |
| Au3+ + 3e = Au | +1,498 |
| Au+ + e = Au | +1,692 |
| Иод | |
| 2IO3- + 6H2O + l0e = I2 + 12OH- | +0,21 |
| IO3- + 3H2O + 6e = I-+ 6OH- | +0,25 |
| 2IO- +2H2O+2e = I2+4OH- | +0,45 |
| IO- + H2O + 2e = I- + 2OH- | +0,49 |
| I2 + 2e = 2I- | +0,536 |
| IO3- + 2H2O + 4e = IO- + 4OH- | +0,56 |
| IO3- +6H+ + 6e = I- + 3H2O | +1,085 |
| 2IO3- + 12H++ 10e = I2 + 6H2O | +1,19 |
| IO4- + 8H+ + 8e = I- + 4H2О | +1,4 |
| 2H IO + 2H+ + 2e = I2+ 2H2O | +1,45 |
| IO4- + 2H+ + 2e = IO3- + H2О | +1,653 |
| Кадмий | |
| Cd(CN)42- + 2e = Cd + 4CN- | -1,19 |
| Cd(NH3)42+ + 2e = Cd + 4NH3 | -0,61 |
| Cd2++2e=Cd | -0,403 |
| Калий | |
| K+ + e = K | -2,924 |
| Кальций | |
| Ca2+ + 2e = Ca | -2,866 |
| Кислород | |
| О2 + 2H2О+ 4e = 4ОH- | +0,401 |
| О2 + 2H+ + 2e = H2О2 | +0,682 |
Продолжение табл. 8
| Электродный процесс | Е0, В |
| H2О2 + 2e = 2ОH- | +0,88 |
| О2 + 4H+ + 4e = 2H2О | +1,228 |
| О3 + H2О + 2e = O2 + 2ОH- | +1,24 |
| О3 + 6H+ + 6e = 3H2О | +1,511 |
| H2О2 + 2Н+ +2e = 2H2О | +1,776 |
| Кобальт | |
| Co(OH)2 + 2e = Co + 2ОH- | -0,73 |
| [Co (NH3)6]2+ + 2e = Co + 6NH3 | -0,42 |
| Co2++2e=Co | -0,277 |
| Co(OH)3 + e = Co(OH)2 + ОH- | +0,17 |
| Co3+ + 3e = Co | +0,33 |
| Co3+ + e = Co2+ | +1,808 |
| Кремний | |
| SiО32- + 3H2О + 4e = Si +6ОН- | -1,7 |
| SiF62- + 4e = Si + 6F- | -1,2 |
| SiО32- + 6Н+ + 4e = Si + 3Н2О | -0,455 |
| Лантан | |
| La3+ + 3e = La | -2,522 |
| Литий | |
| Li++ e = Li | -3,045 |
| Магний | |
| Mg(OH)2 + 2e = Mg + 2ОH- | -2,69 |
| Mg2+ + 2e = Mg | -2,363 |
| Марганец | |
| Mn (OH)2 + 2e = Mn + 2ОH- | -1,56 |
| Mn2+ + 2e = Mn | -1,179 |
| Mn(OH)2 + 2Н+ + 2e = Mn + 2H2О | -0,727 |
| MnO2 + 2H2O + 2e = Mn(OH)2 + 2OH- | -0,05 |
| MnO4- + 4H2O + 5e = Mn(OH)2 + 6OH- | +0,34 |
| MnO4- + e =MnO42- | +0,564 |
| MnO4- + 2H2O + 3e = MnO2 + 4OH- | +0,600 |
| MnO42- + 2H2O + 2e = MnO2 + 4OH- | +0,620 |
Продолжение табл. 8
| Электродный процесс | Е0, В |
| MnO2+ 4H+ + e = Mn3+ + 2H2O | +0,950 |
| MnO2 + 4H+ + 2e = Mn2++ 2H2O | +1,228 |
| MnO4-+ 8H+ + 5e = Mn2+ + 4H2O | +1,507 |
| Mn3+ + e = Mn2+ | +1,509 |
| MnO4-+ 4H+ + 3e = MnO2 + 2H2O | +1,692 |
| MnO42- + 4H+ + 2e = MnO2 + 2H2O | +2,257 |
| Медь | |
| [Cu(CN)2]- + e = Cu + 2CN- | -0,43 |
| [Cu(NH3)2]+ + e = Cu + 2NH3 | -0,12 |
| [Cu(NH3)4]2+ + 2e = Cu + 4NH3 | -0,07 |
| [Cu(NH3)4]2+ + 4H2O + 2e = Cu + 4NH4OH | -0,04 |
| Cu2+ + e = Cu+ | +0,153 |
| 2Cu2+ +Н2О + 2e = Cu2О + 2Н+ | +0,203 |
| Cu2+ + 2e = Cu | +0,337 |
| Cu+ + e = Cu | +0,520 |
| Молибден | |
| MoO42- + 4Н2О + 6e = Mo + 8ОH- | -1,05 |
| Mo3+ +3e = Mo | -0,200 |
| MoО2 + 4H+ + 4e = Mo + 2H2О | -0,072 |
| MoО42- + 8H+ + 6e = Mo + 4H2О | +0,154 |
| MoО42- + 4Н+ + 2e = MoO2 + 2H2О | +0,606 |
| Мышьяк | |
| AsO43-+2H2O+2e=AsO2-+4OH- | -0,658 |
| H3AsO4 + 2H+ +2e=HAsO2 +2H2O | +0,560 |
| Натрий | |
| Na+ + e = Na | -2,714 |
| Никель | |
| Ni(OH)2+2e = Ni+2ОH- | -0,72 |
| [Ni(NH3)6]2+ + 2e = Ni + 6NH3 | -0,49 |
| Ni2++2e = Ni | -0,25 |
| Ni(OH)3+ Н+ + e = Ni(ОH)2 + Н2О | +1,02 |
Продолжение табл. 8
| Электродный процесс | Е0, В |
| Олово | |
| [Sn(OH)4]2- + 2e = Sn + 4ОH- | -0,910 |
| Sn2+ + 2e = Sn | -0,136 |
| Sn4+ + 4e = Sn | +0,100 |
| Sn4+ + 2e = Sn2+ | +0,151 |
| Платина | |
| PtBr42- + 2e = Pt + 4Br- | +0,58 |
| PtCl62- + 2e = PtCl42- + 2CI- | +0,72 |
| PtCl42- + 2e = Pt +4C1- | +0,73 |
| Pt2+ + 2e = Pt | +1,188 |
| Рений | |
| ReO4- + 4H2О + 7e = Re + 8OH- | -0,584 |
| Re3+ + 3e = Re | +0,3 |
| ReО4- + 8H+ + 4e = Re3+ + 4H2О | +0,422 |
| Ртуть | |
| [Hg(CN)4]2- + 2e = Hg + 4CN- | -0,37 |
| [Hgl4]2- + 2e = Hg + 4l- | -0,04 |
| [HgBr4]2-+ 2e =Hg+4Br- | +0,21 |
| Hg2Cl2 + 2e = 2Hg + 2C1- | +0,268 |
| [HgCl4]2- + 2e = Hg + 4C1- | +0,48 |
| Hg22+ + 2e = 2Hg | +0,788 |
| Hg2++2e = Hg | +0,854 |
| 2Hg2+ + 2e = Hg22+ | +0,920 |
| Рубидий | |
| Rb++e = Rb | -2,925 |
| Свинец | |
| PbSO4 + 2е = Pb + SO42- | -0,36 |
| Pb2+ + 2e = Pb | -0,126 |
| PbО32-+ H2О + 2e = PbO22- + 2ОH- | +0,20 |
| PbO+2H++2e = Pb + H2О | +0,248 |
| PbO2 + H2O + 2e = PbO + 2OH- | +0,28 |
| PbO2 + 4H+ + 2e = Pb2+ + 2H2O | +1,449 |
Продолжение табл. 8
| Электродный процесс | Е0, В |
| PbO2 + 4H+ + SO42- + 2e = PbSO4 + 2H2O | +1,68 |
| Pb4+ + 2e = Pb2+ | +1,694 |
| Селен | |
| Se + 2H+ + 2e = H2Se (ж) | -0,399 |
| Se + 2H+ + 2e = H2Se (г) | -0,369 |
| SeО32- + 3H2О + 4e = Se +6ОH- | -0,366 |
| SeО42- + H2О + 2e = SeO32- +2ОH- | +0,05 |
| H2SeО3 + 6H+ + 6e = H2Se(ж) + 3H2О | +0,36 |
| H2SeО3 + 4H+ + 4e = Se + 3H2О | +0,74 |
| SeО42- + 2H+ + 2e =H2SeO3 + H2O | +1,15 |
| Сера | |
| SO42- + H2О + 2e = SO32- + 2ОН- | -0,93 |
| 2SО42- + 5Н2О + 8e = S2O32- + 10OH- | -0,76 |
| S + 2e = S2- | -0,48 |
| S2О32- + 6H++ 8e = 2S2- + 2H2О | -0,006 |
| SO42- + 8H+ +8e = S2- + 4H2О | +0,149 |
| SO42- + 4H+ +2e = SO2 + 2H2О | +0,159 |
| S +2H+ +2e = H2S | +0,17 |
| SO42- +2H+ + 2e = SO32- + H2О | +0,22 |
| SO32- + 6Н++ 6e = S2- + 3H2О | +0,231 |
| HSO4- + 9H+ + 8e = H2S(р) + 4H2О | +0,289 |
| SО42- + 10H+ + 8e = H2S + 4H2О | +0,311 |
| HSO4- + 7Н+ + 6e = S + 4H2О | +0,339 |
| SО42- + 8H+ + 6e = S + 4H2О | +0,357 |
| S2О32- + 6H+ + 4e = 2S + 3H2О | +0,5 |
| 2SO32- + 6H+ + 4e = S2O32- + 3H2О | +0,705 |
| S2О82- + 2e = 2SО42- | +2,01 |
| Серебро | |
| [Ag(CN)2]- + e = Ag + 2CN- | -0,29 |
| [Ag(S2О3)2]3- +e = Ag+2S2О32- | +0,01 |
| AgCl + e = Ag + Cl- | +0,222 |
| [Ag(NH3)2]++e = Ag+2NH3 | +0,373 |
| Ag+ + e = Ag | +0,799 |
Продолжение табл. 8
| Электродный процесс | Е0, В |
| Стронций | |
| Sr2+ + 2e = Sr | -2,888 |
| Таллий | |
| Tl++ e = Tl | -0,344 |
| Tl3+ + 2e = Tl+ | +1,252 |
| Теллур | |
| Te + 2e = Te2- | -1,143 |
| Титан | |
| Ti2++ 2e = Ti | -1,63 |
| [TiF6]2- + 4e = Ti + 6F- | -1,191 |
| Ti4++ 4e = Ti | -0,88 |
| TiO2 + 4H+ + 4e = Ti + 2H2О | -0,86 |
| Ti3+ + e = Ti2+ | -0,368 |
| Ti4+ + e = Ti3+ | -0,092 |
| Углерод | |
| 2CO2 + 2H+ + 2e = H2C2О4 | -0,49 |
| CO2+2H++2e = HCOOH | -0,2 |
| CО2+2H++2e = CO+ H2О | -0,12 |
| CО32- + 8H+ +6e = CH3OH + 2H2О | +0,209 |
| CО32- + 3H+ + 2e = HCOO- + H2О | +0,227 |
| 2CО32- + 4H+ + 2e = C2О42- + 2H2О | +0,441 |
| Фосфор | |
| PО43- + 2Н2О + 2e = HPO32- + 3ОH- | -1,12 |
| H3PО3 + 3H+ + 3e = P (белый) + 3H2О | -0,502 |
| H3PО3 + 3H+ + 3e = P (красный) + 3H2О | -0,454 |
| H3PО4 + 5Н+ + 5e = P (белый) + 4H2О | -0,411 |
| H3PO4 + 5Н+ + 5e = P (красный) + 4Н2О | -0,383 |
| H3PО4 + 2H+ + 2e = H3PО3 + H2О | -0,276 |
| P (красный) + 3H++ 3e = PH3 | -0,111 |
| P (белый) + 3H+ + 3e = PH3 | -0,063 |
Продолжение табл. 8
| Электродный процесс | Е0, В |
| Фтор | |
| F2О + 2H+ + 4e = 2F- + H2О | +2,1 |
| F2 + 2e = 2F- | +2,87 |
| Хлор | |
| ClО4- + H2O + 2e = C1О3- + 2ОH- | +0,36 |
| 2ClO- + 2Н2О + 2e = Cl2 + 4ОH- | +0,4 |
| C1О4- + 4H2O + 8e = Cl- + 8OH- | +0,56 |
| C1О3- + 3H2O + 6e = Cl- + 6ОH- | +0,63 |
| C1О- + H2О + 2e = Cl- + 2ОH- | +0,88 |
| ClO4- + 2H+ + 2e = C1О3- + Н2О | +1,189 |
| Cl2 + 2e = 2C1- | +1,359 |
| C1О4- + 8Н+ + 8e = Cl- + 4H2О | +1,38 |
| 2C1О4- + 16H+ + 14e = Cl2+ 8H2О | +1,39 |
| C1О3- + 6Н+ + 6e = Cl- + 3H2О | +1,451 |
| 2C1О3- + 12H+ + l0e = Cl2 + 6Н2О | +1,47 |
| 2HC1О + 2Н+ + 2e = Cl2 + 2H2О | +1,63 |
| Хром | |
| CrO2- + 2H2О + 3e = Cr + 4ОH- | -1,2 |
| Cr2+ + 2e = Cr | -0,913 |
| Cr3+ + 3e = Cr | -0,744 |
| Cr3+ + e = Cr2+ | -0,407 |
| CrO2- + 4H+ + 3e = Cr + 2H2О | -0,213 |
| CrO42-+ 4H2О + 3e = Cr(OH)3 + 5ОH- | -0,13 |
| Cr2О72- + 14Н+ + 12e = 2Cr + 7H2О | +0,294 |
| CrO42- + 8H+ + 6e = Cr + 4H2О | +0,366 |
| CrO42- + 4H+ + 3e = CrO2- + 2H2О | +0,945 |
| Cr2O72-+ 14Н+ + 6e = 2Cr3+ + 7Н2О | +1,333 |
| CrО42- + 8H+ + 3e = Cr3+ + 4H2О | +1,477 |
| Цезий | |
| Cs+ + e = Cs | -2,923 |
| Цинк | |
| [Zn(CN)4]2- + 2e = Zn + 4CN- | -1,26 |
Окончание табл. 8
| Электродный процесс | Е0, В |
| ZnO22- + 2H2О + 2e = Zn + 4ОH- | -1,216 |
| [Zn(OH)4]2- + 2e = Zn + 4ОH- | -1,216 |
| [Zn(NH3)4]2+ + 2e = Zn + 4NH3 | -1,04 |
| Zn2+ + 2e = Zn | -0,763 |
| ZnO22- + 4H+ + 2e = Zn + 2H2О | +0,441 |
23. ПЕРЕНАПРЯЖЕНИЕ ВОДОРОДА ( 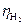 ) И КИСЛОРОДА (
) И КИСЛОРОДА (  )
)
Date: 2015-10-19; view: 1238; Нарушение авторских прав