
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Галогенирование
|
|
Br Br
½ ½
СН3 – СН = СН2 + Br2 ® СН3 – СН – СН2
1,2–дибромпропан
Реакция галогенирования служит для качественного и количественного определения непредельных соединений. Реакция обесцвечивания брома является классической качественной и количественной реакцией на двойную связь.
Например, по количеству поглощенного брома или йода можно установить содержание непредельных высших жирных кислот в составе липидов.
3. Гидрогалогенирование:
СН3 –СН=СН2 + НСl ® СН3 – СН – СН3
½
Cl
2–хлорпропан
Присоединение галогенводородов к несимметричным алкенам происходит в соответствии с правилом Марковникова: водород направляется преимущественно к наиболее гидрогенизированному атому углерода. Обосновать правило Марковникова можно, учитывая два фактора:
 1. Статический фактор – распределение электронной плотности в молекуле алкена в исходном состоянии:
1. Статический фактор – распределение электронной плотности в молекуле алкена в исходном состоянии:
d+ d -
СН3 ®СН=СН2
Положительный индуктивный эффект СН3 – группы приводит к поляризации p- связи и атаке электрофила Н+ первого атома углерода.
2. Динамический фактор – оценка относительной устойчивости возникающих промежуточных частиц:
+
атака С1 СН3 ® СН СН3

 (I)
(I)
3 2 1
 СН3 – СН = СН2 + Н+
СН3 – СН = СН2 + Н+
атака С2 +
 СН3®СН2®СН2
СН3®СН2®СН2
(II)
Карбкатион (I) более стабилен, так как положительный заряд стабилизируется +I –эффектами двух алкильных (метильных) групп. Карбкатион (II) менее стабилен за счет +I–эффекта только одной алкильной (этильной) группы.
Реакция протекает с предпочтительным образованием наиболее устойчивого карбкатиона (I):
Сl
+ +Cl- ½
СН3-СН =СН2 + Н+ ® СН3-СН-СН3 ® СН3 – СН-СН3
4. Гидратация:
ОН
d+  d- Н+ ½
d- Н+ ½
 CH3 ® С = СН2 + Н2О СН3 – С- СН3
CH3 ® С = СН2 + Н2О СН3 – С- СН3
½
СН3 СН3
2 – метилпропен 2–метилпропанол–2
Реакция протекает также в соответствии с правилом Марковникова.
5. Окисление (по Вагнеру). При окислении алкенов разбавленными растворами перманганата калия в нейтральной или слабощелочной среде получаются двухатомные спирты (гликоли):


 3 СН2 = СН2 + 2 КMnO4 + 4H2O 3 CH2 –CH2 + 2KOH + 2MnO2
3 СН2 = СН2 + 2 КMnO4 + 4H2O 3 CH2 –CH2 + 2KOH + 2MnO2
этилен
OH OH
этиленгликоль
Реакция используется как качественная для обнаружения двойной связи (по обесцвечиванию раствора KMnO4).
6. Полимеризация:
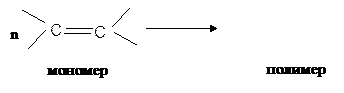 ½ ½
½ ½
(¾ С ¾ С ¾) n
½ ½
 | 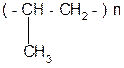 | ||||
 | |||||
пропилен полипропилен
Date: 2015-10-22; view: 503; Нарушение авторских прав