
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Контрольные задания. Для указанных в таблице 3 элементов составьте электронные и электронно-графические формулы
|
|
Для указанных в таблице 3 элементов составьте электронные и электронно-графические формулы. Укажите валентные электроны и степени окисления. Напишите формулы возможных соединений этих элементов с кислородом и водородом. Укажите характер оксидов, уравнениями реакций докажите их важнейшие химические свойства и изобразите их графические формулы.
Таблица 3
| № | Элементы | Поясните, |
| Ca, Sc | почему эти элементы расположены в одном периоде, в разных группах и подгруппах? | |
| Si, Ti | почему эти элементы стоят в разных периодах, в одной группе, но в разных подгруппах? | |
| P, Al | почему эти элементы стоят в одном периоде, в разных группах, но в одних подгруппах? | |
| Р, V | почему эти элементы стоят в разных периодах, в одной группе, но в разных подгруппах? | |
| Fe, Сr | у оксида железа (II) или у оксида хрома(II) сильнее выражен основной характер? | |
| Fe, Cr | у какого оксида и почему сильнее выражены кислотные свойства: FeO3 и CrO3? | |
| S, Se | почему эти элементы стоят в разных периодах, в одной группе и подгруппе? | |
| C, Si | у какого элемента и почему энергия ионизации больше? | |
| Ge, Zr | у какого оксида и почему сильнее выражены основные свойства: GeO2 и ZrO2? | |
| Mg, P, Al | как и почему изменяются кислотно-основные свойства высших оксидов в ряду магний, алюминий, фосфор? | |
| S, Al | y какого оксида и почему сильнее выражены кислотные свойства: SO2 и Al2O3? | |
| Al, S | у какого оксида и почему сильнее выражены кислотные свойства Al2O3 и SO3? | |
| Mn, Cl | почему эти элементы стоят в разных периодах, в одной группе, но в разных подгруппах? | |
| Ga, As | у какого оксида и почему сильнее выражены основные свойства: Ga2O3 и As2O3? | |
| Ti, Ge | у какого оксида и почему сильнее выражены основные свойства: TiO и GeO? | |
| Ti, Hf | укажите, у какого оксида и почему сильнее выражены основные свойства: Ti2O3 и Hf2O3? | |
| №15 и №28 | объясните, почему фосфор проявляет отрицательную степень окисления, а никель нет? | |
| №21 и №31 | укажите, к какому семейству они относятся, и объясните, почему они стоят в одном периоде, в одной группе, но в разных подгруппах? | |
| №33 и №23 | объясните, почему мышьяк образует газообразное водородное соединение, а ванадий не образует? | |
| №34 и №74 | почему эти элементы стоят в разных периодах, в одной группе, но в разных подгруппах? |
Тема 2. Химическая связь и строение молекул
Задания 21-40 (таблица 4)
Пример:
Определите тип химических связей в молекулах Br2, HBr, KBr. Приведите схемы перекрывания электронных орбиталей при образовании ковалентных связей в указанных молекулах.
Решение:
Br2: молекула брома образована из атомов одного элемента. Электроотрицательность брома равна 2,8 (таблица 19), поэтому Δ электроотрицательности = 2,8 – 2,8 = 0, следовательно, связь в молекуле брома Br2 –ковалентная неполярная, (Br- Br).
HBr: Δ электроотрицательности = 2,8 - 2,1 = 0,7, т.е. <0,7 => ковалентная полярная связь, связующая электронная пара смещена в сторону атома брома (Hδ+→Brδ-). Поэтому атом водорода приобретает эффективный положительный заряд, а брома – эффективный отрицательный.
KBr: Δ электроотрицательности = 2,8 - 0,91 = 1,89, т.е.>1,7 => связь преимущественно ионная, (K-Br).
У атома брома валентными являются электроны четвертого энергетического уровня: …4s24p5,
s p
| ↑↓ | ↑↓ | ↑↓ | ↑ |
В=I
неспаренный электрон находится на р-орбитали, электронная орбиталь имеет форму гантели.
Образование химической связи в молекуле Br2 можно отобразить схемой:

 |  |
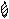
 + →
+ →
Br Br Br — Br
У атома водорода валентными является 1s-электрон, его электронная орбиталь имеет сферическую форму.
Схема образования химической связи в молекуле HBr.
 |  | ||||
 | |||||

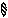
 + →
+ →
H Br H — Br
Date: 2015-10-22; view: 938; Нарушение авторских прав