
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Хромопротеины
|
|
Для них простетическая часть окрашена (chromos – краска). К хромопротеинам относятся гемоглобин, миоглобин, каталаза, пероксидаза, ряд флавинсодержащих ферментов (сукцинатдегидрогеназа, альдегидоксидаза, ксантиноксидаза), цитохромы (гемсодержащие белки) и т.д. Велика биологическая роль этих белков – участвуют в физиологических процессах: дыхание клетки, транспорте кислорода и углекислого газа, окислительно-восстановительных процессах.
Гемоглобин. Его белковая часть представлена глобином, небелковая – гемом. Это олигомерный белок, т.е. имеет четвертичную структуру, состоящую из 4 субъединиц.
a цепи построены из 141 АК-остатка.
b цепи из 146 АК-остатков [рис. 4-х субъединиц, в каждой нарисована точка - гем].
Каждая из субъединиц связана с гемом:
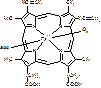 [гем]
[гем]
Основная функция гемоглобина – транспортная (кислород, углекислый газ). Также он представляет собой основную буферную систему крови (75% от всей буферной емкости крови).
Различают:
- HbO2 – оксигемоглобин (связан с молекулой O2);
- HbCO – карбоксигемоглобин;
- HbCO2 – карбгемоглобин;
- HbOH – метгемоглобин (образуется при соединении с нитросоединениями, не способен связывать кислород).
Типы гемоглобина. Всего известно более 100 типов, но их все делят на 2 группы:
1) Физиологические гемоглобины;
2) Патологические (аномальные).
К физиологическим гемоглобинам относятся:
- Hb P – примитивный гемоглобин, имеет место быть у 1-2 недельного эмбриона;
- Hb F – фетальный или гемоглобин плода, к моменту рождения составляет около 70% всего гемоглобина в крови;
- Hb A, Hb A2, Hb A3 – это гемоглобины взрослого организма. На Hb A приходится около 90-96%.
Физиологические типы гемоглобинов отличаются глобулиновой частью (АК-составом). Например Hb A содержит 2a и 2b субъединицы, а Hb F – 2a и 2g субъединицы.
К аномальным (возникающих при наследственных заболеваниях) гемоглобинам относятся:
- HbS – гемоглобин, сопутствующий серповидно-клеточной анемии. Отличается от нормального тем, что с N-конца в 6 положении b–цепи глутамин заменен на валин.
Миоглобин по сравнению с гемоглобином имеет третичную структуру, одну полипептидную цепь, один гем и может связывать одну молекулу кислорода. Гемоглобин и миоглобин функционируют вместе. Гемоглобин доставляет кислород из легких к тканям, а миоглобин перераспределяет его внутри клетки (доставляет к митохондриям).
Оба белка – гемопротеины, т.е. гемсодержащие белки.
ГЕМОГЛОБИНОПАТИЯ (от гемоглобин и...патия) (гемоглобиноз) -группа наследственных заболеваний, обусловленных присутствием в эритроцитах дефектных гемоглобинов.Основное проявление - гемолиз. См. Серповидноклеточная анемия, Талассемия.
4.Ферменты – биокатализаторы. Активный центр ферментов. Его формирование у ферментов с различной структурой. Активаторы и ингибиторы.
Строение ферментов. В пространственной структуре фермента условно выделяют ряд участков, которые выполняют соответствующие им функции. Активный центр (АЦ) – участок в молекуле фермента, где происходит связывание и химическое превращение субстрата (S). Субстрат – вещество, подвергающееся химическому превращению (например, для фермента лактатдегидрогеназы (ЛДГ) субстратом будет молочная кислота). В активном центре выделяется контактный участок и каталитический участок. Контактный участок – это место активного центра, в котором происходит связывание фермента с субстратом по принципу комплементарности, т.е. именно контактный участок обеспечивает специфическое сродство субстрата ферменту. Образовавшийся комплекс носит название фермент-субстратный комплекс. Каталитический участок (центр) – это место в активном центре фермента, где происходит химическое превращение субстрата [рис. изображён фермент-субстратный комплекс, а именно контактный участок, каталитический участок, активный центр и субстрат].
Если фермент – сложный белок, то обычно простетическая часть находится тоже в активном центре и участвует в формировании активного центра. Активный центр занимает небольшую часть молекулы фермента, обычно располагается в углублении, и в его образовании участвует небольшое число аминокислотных остатков (до 20). Аминокислотные остатки могут быть удалены друг от друга, но при формировании пространственной структуры фермента они располагаются в области активного центра.
В формировании активного центра могут участвовать остатки, несущие следующие функциональные группы: NH2 (ЛИЗ, АРГ), COOH (ГЛУ, АСП), OH (СЕР, ТРЕ), SH (ЦИС), имидазольное кольцо (ГИС). В качестве единиц, участвующих в формировании активного центра, могут выступать кофакторы - ионы металлов (Cu2+, Fe2+ и т.д.), а также коферменты. В сложном ферменте АК-остатки активного центра создают условия для правильной его конформации и помогают кофакторам в связывании, ориентации, а, следовательно, и в превращении субстрата.
Боковые группы остальных аминокислот не участвуют в образовании активного центра, но обеспечивают правильную пространственную конформацию активного центра и влияют на его реакционную способность.
Ряд ферментов могут содержать аллостерический центр. [рис. фермента с аллостерическим и активным центрами] Эти ферменты относят к аллостерическим ферментам. К аллостерическому центру присоединяются различные вещества, отличные по строению от субстрата. Эти вещества могут изменять конформацию активного центра, т.е. влиять на связывание и превращение субстрата, они называются аллостерическими эффекторами. Все аллостерические эффекторы делятся на положительные – активаторы, и отрицательные – ингибиторы.
5.Ферменты. Регуляция действия ферментов: аллостерические механизмы, протеолиз.
Date: 2015-09-25; view: 1121; Нарушение авторских прав