
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Примеры решения типовых задач. Пример 1. Для определения относительной молекулярной массы вещества, являющегося незлектролитом, его навеска массой 1,764 г была растворена в воде
|
|
Пример 1. Для определения относительной молекулярной массы вещества, являющегося незлектролитом, его навеска массой 1,764 г была растворена в воде, и объем раствора доведен до 100 мл. Измеренное осмотическое давление раствора оказалось равным 2,38∙10 Па при 20оС. Рассчитайте молярную массу указанного вещества.
Решение. В растворе объемом 1 м3 масса вещества составляет 17640 г. Из уравнения Вант-Гоффа, подставляя в это выражение экспериментальные данные, получим:
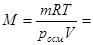
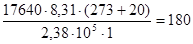 г/моль
г/моль
Пример 2. Навеска вещества массой 12,42 г растворена в воде объемом 500 мл. Давление пара полученного раствора при 25 0С равно 3297,8 Па. Как по этим данным найти молярную массу растворенного вещества?
Решение. Для определения молярной массы растворенного вещества М1 надо вычислить количество молей растворенного вещества ν1, пользуясь законом Рауля:
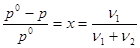 ,
,
где: р - давление пара над раствором;
р0 – давление пара над чистой водой, его значение при 250С согласно табл 14 []
равно 3306 Па;
ν2 = 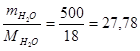 моль, после подстановки в закон Рауля получим:
моль, после подстановки в закон Рауля получим:
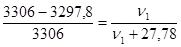 ; отсюда ν1 = ν(вещества) = 0,069 моль;
; отсюда ν1 = ν(вещества) = 0,069 моль;
М1 =  г/моль
г/моль
Пример 3. Раствор, содержащий 0,85 г хлористого цинка ZnС12 в 125 г воды, замерзает при —0,23 °С. Определите кажущуюся степень диссоциации хлористого цинка в этом растворе.
Решение. Выразим прежде всего моляльную концентрацию раствора в молях на 1000 г воды. Так как молярная масса хлористого цинка равна 136 г/моль, то
 моль/кг
моль/кг
Для растворов электролитов величина понижения точки замерзания рассчитывается по формуле
∆t зам. = i∙ К∙Ст
Криоскопическая постоянная К для воды из табл.14[] равна 1,86, следовательно, изотонический коэффициент данного раствора составит:
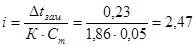
Степень диссоциации связана с величиной изотонического коэффициента соотношением:
 или 73,5%
или 73,5%
Здесь п – количество ионов, образующихся при диссоциации молекулы ZnCl2.
10. ИОННО-МОЛЕКУЛЯРНЫЕ РЕАКЦИИ ОБМЕНА
Примеры решения задач
Пример 1. ПР(РbSО4) = 2,2.10-8. Чему равна концентрация ионов Рb2+ и SО42- в насыщенном растворе сульфата свинца и его растворимость, выраженная молярной и массовой концентрациями?
Date: 2015-09-25; view: 1550; Нарушение авторских прав