
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Скорость химических реакций
|
|
121. Начальная концентрация серной кислоты в реакции:
MgСО3 (т) + H2SO4(раствор) →MgSO4(раствор) +СО2(г) + H2О(раствор)
равнялась 10%масс. Как изменится скорость данной реакции при снижении концентрации H2SO4 до 5%масс.?
122. Как следует изменить температуру для уменьшения скорости реакции в 32 раза, если температурный коэффициент скорости составляет 2.
123. Константа скорости реакции омыления уксусноэтилового эфира:
СН3СООС2Н5(р-р) + КОН(р-р)→СН3СООК (р-р) +С2Н5ОН(р-р)
равна 0,1 л/моль∙мин. Начальная концентрация уксусноэтилового эфира была равна 0,01 моль/л, а щелочи – 0,05 моль/л. Вычислите начальную скорость реакции и в тот момент, когда концентрация эфира станет равной 0,008 моль/л.
Ответ: 5,0∙10-5 и 3,84∙10-5 моль/л∙мин.
124. При повышении температуры с 40 до 65оС скорость гомогенной реакции возросла в 40 раз. Рассчитайте температурный коэффициент и энергию активации данной реакции.
125. Рассчитайте скорость реакции между растворами хлорида калия и нитрата серебра, концентрации которых составляют соответственно 0,2 и 0,3 моль/л, а k=1,5∙10-3л∙моль-1∙с-1
126. Начальные концентрация исходных веществ в системе:
N2(г) +3H2(г) ↔ 2NH3(г)
составили: азота – 0,5 моль/л, водорода – 3 моль/л. Как изменится скорость данной реакции к моменту, когда в системе образуется 0,1моль/л аммиака?
127. Как следует изменить концентрацию кислорода, чтобы скорость гомогенной элементарной реакции:
2 NО(г) +O2(г) → 2 NО2(г)
не изменилась при уменьшении концентрации оксида азота (II) в 2 раза?
128. Как следует изменить объем реакционной смеси системы:
8NH3(г) + 3Br2(ж)→6NH4Br(к) + N2(г),
чтобы скорость реакции уменьшилась в 60 раз?
129. При увеличении температуры с 30 до 45оС скорость гомогенной реакции повысилась в 20 раз. Чему равна энергия активации реакции?
130. Как следует изменить концентрацию оксида серы (IV), чтобы скорость гомогенной элементарной реакции:
2SO2 + O2 → 2SO3
не изменилась при увеличении концентрации кислорода в 8 раз?
131. Исходные концентрации оксида углерода (II) и кислорода в системе:
СО (г)+ 2 Н2 (г) ↔ СН3ОН (ж)
равны соответственно 0,01 и 0,05 моль/л. Как изменятся их концентрации к тому моменту, когда скорость реакции снизится в 3 раза по сравнению с исходной?
132. Как следует изменить давление в системе:
2С2Н2(г) + 3H2O(г) → С3Н6О(г) + СО2(г) + Н2(г)
чтобы увеличить скорость реакции 400 раз?
133. Как изменится скорость реакции:
Fe2O3(к) + 3 СО(г) ↔ 2 Fe(к) + 3СО2(г) ,
если
а) увеличить объем системы в 3 раза?
б) увеличить давление в системе в 5 раз?
134. Рассчитайте скорость реакции между растворами сульфата натрия и нитрата бария, концентрации которых составляют соответственно 0,3 и 0,5 моль/л, а k=9,2∙10-4л∙моль-1∙с-1
135. При 509оС константа скорости реакции: 2HI → H2 + I2 составляет 0,0047 л/(моль∙мин). Вычислите концентрацию НI, если скорость реакции равна 5,8·10-4 моль/(л∙мин).
136. Определите температурный коэффициент скорости реакции между карбонатом магния и серной кислотой, если известно, что при 250С растворение происходит за 16 сек, а при 550С – за 2 сек.
137. Начальная концентрация исходных веществ в системе H2 + I2 → 2HI
была равна 0,7 и 0,3 моль/л. Как изменится скорость реакции к тому моменту, когда концентрация НI станет равна 0,2 моль/л?
138. Как изменится скорость реакции, протекающей в системе:
MnO2(к) + 4HCl(г) → MnCl2(к) + Cl2(г) + 2 Н2О(г)
при увеличении давления в ней в 2 раза?
139. Как следует изменить давление в системе:
4HI(г) +O2(г) →2I2(г) + 2H2О(г)
чтобы скорость реакции возросла в 243 раза?
140. Энергия активации реакции равна 64,3 кДж/моль. Во сколько раз уменьшится скорость реакции при нагревании реакционной смеси с 25 до 70оС?
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
141. Какие условия будут способствовать выходу SO3 по реакции:
2SO2 + O2 ↔ 2SO3 ; ΔНо298 = - 98,9 кДж/моль?
Напишите выражение константы равновесия данной реакции.
142. Как повлияет на выход хлора в системе:
4HCl(г) +O2(г) ↔2Cl2(г) + 2H2О(ж); ΔНо298 =−202,4кДж
а) повышение температуры; б) уменьшение общего объема смеси; в) уменьшение концентрации кислорода; д) введение катализатора?
143. Константа равновесия системы:
2NО (г) +О2 (г) ↔ 2NО2 (г)
равна при некоторой температуре 2,22, а начальная концентрация NО составила 2,8 моль/л. Какова должна быть начальная концентрация О2, чтобы доля окисленного NO составила 60%?
144. При каких условиях равновесие реакции:
MnO2(к) + 4HCl(г) ↔ MnCl2(к) + Cl2(г)
будет смещаться в сторону образования Cl2? Напишите выражение константы равновесия данной реакции.
145. Почему при изменении давления смещается равновесие реакции:
N2(г) +3H2(г) ↔ 2NH3(г),
и не смещается равновесие реакции:
FeO(к) + CO(г)↔Fe(к) + CO2(г)?
Напишите выражения констант равновесия данных реакций.
146. Равновесие в системе H2(г)+ I2(г)↔ 2HI(г) установилось при следующих концентрациях участников реакции: HI – 0,05 моль/л, водорода и иода – по 0,01моль/л. Как изменятся концентрации водорода и иода при повышении концентрации HI до 0,08моль/л?
147. Константа равновесия реакции:
СОСl2(г) ↔ СО(г)+С12(г)
равна 0,02. Исходная концентрация СОCl2 составила 1,3 моль/л. Рассчитайте равновесную концентрацию Сl2. Какую исходную концентрацию СОCl2 следует взять, чтобы увеличить выход хлора в 3 раза?
148. Напишите выражение для константы равновесия гомогенной системы:
СН4(г) + СО2(г) ↔ 2 СО(г) + 2 Н2(г) ΔНо298>0;
Как следует изменить температуру и давление, чтобы увеличить выход водорода? Как повлияет на величину выхода водорода увеличение концентрации СН4?
149. Константа равновесия системы:
СCl4(г) ↔ 2Cl2 (г) +C (к)
при температуре 700 К составляет 0,77. Равновесная концентрация хлора составила 0,5 моль/л. Рассчитайте равновесную и начальную концентрацию СCl4.
150. Константа равновесия реакции:
PCl5 ↔ PCl3 + Cl2
равна 0,63 при 500оС. Исходная концентрация PCl5 равна 1,2 моль/л. Рассчитайте равновесные концентрации PCl3 и Cl2.
151. Исходные концентрации водорода и иода в системе:
H2(г)+ I2(г)↔ 2HI(г)
равны соответственно 1,55 и 1,0 моль/л.Рассчитайте константу равновесия системы, если известно, что к моменту установления равновесия прореагировало 90% I2.
152. В каком направлении сместится равновесие системы:
СО(г) + 3 Н2(г) ↔ СН4(г) + Н2О(г); ΔНо298<0
а) при понижении температуры; б) введении катализатора; в)повышении давления? Напишите выражение константы равновесия данной реакции.
153. В системе:
СО(г)+С12(г) ↔ СОСl2(г)
начальная концентрация СО и С12 была равна 0,28 и 0,09 моль/л; равновесная концентрация СО равна 0,20 моль/л. Найдите константу равновесия.
154. Восстановление Fe3O4 водородом протекает по уравнению:
Fe3O4(к) + 4 H2(г) ↔ 3 Fe(к) + 4 H2O(г) ; ΔНо298 > 0
Как следует изменить: а) температуру; б) концентрацию водорода; в) давление в системе, чтобы увеличить выход железа? Напишите выражение константы равновесия данной реакции.
154. Для реакции:
FeO(к) + CO(г)↔Fe(к) + CO2(г)
константа равновесия при 1000оС равна 0,5. Начальные концентрации СО и СО2 были соответственно равны 0,05 и 0,01 моль/л. Найдите их равновесные концентрации.
156. В какую сторону смещается химическое равновесие в следующих обратимых реакциях при: а) повышении температуры; б) уменьшении давления.
1) N2(г) + О2(г) 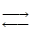 2NО(г); DН > 0;
2NО(г); DН > 0;
2) СО2(г) + С(к) 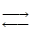 2СО(г); DН < 0?
2СО(г); DН < 0?
157. В каком направлении сместится равновесие в системе:
SO3(г) + C(к) ↔ SO2(г) + CO(г)); ΔНо298<0
а) при уменьшении общего объема смеси; б) уменьшении концентрации SO2; в) введении катализатора; г) увеличении температуры? Напишите выражение константы равновесия данной реакции.
158. Исходные концентрации NО и О2 в реакции:
2NО (г) +О2 (г) ↔ 2NО2 (г)
соответственно равны 0,025 и 0,0325 моль/л. Вычислите равновесные концентрации всех веществ и константу равновесия, если известно, что к моменту установления равновесия прореагировало 20% NО.
159. В каком направлении сместится равновесие в системе:
СО2 (г)+Н2 (г) ↔ СО (г)+Н2О (ж); ΔНо298<0
а) при увеличении давления; б) уменьшении концентрации SO2; в) введении катализатора; г) увеличении температуры? Напишите выражение константы равновесия данной реакции.
160. В системе:
PCl5 ↔ PCl3 + Cl2
равновесие при 500 оС установилось, когда исходная концентрация PCl5, равная 1 моль/л, уменьшилась до 0,46 моль/л. Найдите значение константы равновесия при указанной температуре.
КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ
161. Из скольких атомов состоит молекула иода в спиртовом растворе, если раствор 6,35 г иода в100 г этанола кипит при 78,59оС?
162. Давление пара 10%-ного водного раствора бромида аммония при 100оС равно 0,9560∙105 Па. Давление пара чистой воды при 100оС равно 1,0133∙105 Па. Чему равна степень диссоциации данной соли?
163. Сколько граммов глюкозы С6Н12О6 было растворено в 0,5л воды, если температура кипения полученного раствора составила 1020С?
164. Чему равна температура замерзания раствора AlCl3 с молярной концентрацией эквивалента 0,3 моль/л, если его степень диссоциации равна 60%?
165. В каком количестве воды надо растворить 6,84 г глюкозы С6Н12О6, чтобы давление пара воды, равное при 65оС 250 гПа, снизилось до 248 гПа?
166. Найдите относительную молярную массу неэлектролита, если его 10%-ный раствор кипит при 100,60С.
167. Какое осмотическое давление будет иметь при 40оС 6%-ный водный раствор Ва(ОН)2, если экспериментально найденная степень диссоциации данной соли равна 72%?
168. Температура кипения раствора, полученного растворением 9,6 г NH4Cl в 900мл воды, равна 100,09оС. Найдите величину степени диссоциации данной соли.
169. Сколько воды надо прибавить к 2 л раствора сахара, чтобы понизить его осмотическое давление в 3 раза?
170. Вычислите давление насыщенного пара 5%-ного раствора сульфата меди, имеющего степень диссоциации 65%.
171. Какое осмотическое давление имеет раствор 50 г мочевины (NH2)2CO в 4 л воды при 15оС и до какой температуры его надо нагреть, чтобы повысить осмотическое давление на 25 кПа?
172. Найдите молекулярную формулу серы, зная, что температура кипения чистого бензола на 0,081оС ниже температуры кипения 0,8%-ного раствора серы в бензоле.
173. Рассчитайте при 25оС давление насыщенного пара диэтилового эфира над раствором 0,8 г бутанола в 20 мл диэтилового эфира.
174. Сколько граммов глицерина С3Н5(ОН)3 следует растворить в 250 г воды при 250С, чтобы понизить давление насыщенного пара воды на 20 Па?
175. При 200С давление насыщенного пара бензола равно 100кПа. Рассчитайте давление насыщенного пара над раствором бензола С6Н6, в 83 г которого содержится 12,8 г нафталина С10Н8.
176. Вычислите, как различаются температуры замерзания 5%-ных водных растворов сахара С12Н22О11 и хлорида алюминия, если степень диссоциации соли равна 80%-ной.
177. При растворении 2,3 г некоторого неэлектролита в 100 г воды температура кипения повысилась на 0,26 градусов. Рассчитайте молярную массу данного неэлектролита.
178. Раствор, полученный из 500г циклогексана С6Н12 и 0,1 моль бензола С6Н6, кристаллизуется при температуре на 4оС ниже, чем чистый циклогексан. Рассчитайте значение криоскопической постоянной циклогексана.
179. Экспериментальные значение степени диссоциации нитратов серебра и алюминия в 0,1 m растворах приблизительно одинаковы и равны 80%. Как различаются температуры плавления данных растворов?
180. Рассчитайте массовую долю хлорида натрия в физиологическом растворе, осмотическое давление которого при 25оС составляет 762,7 кПа (α=1, ρ=1г/см3).
Date: 2015-09-25; view: 1248; Нарушение авторских прав