
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Химическая связь
|
|
Химической связью называется совокупность взаимодействий между электронами и ядрами, приводящих к соединению атомов в молекулу. Различают ковалентную, ионную и металлическую связи.
Ионная связь – прочная химическая связь, образующаяся между атомами с большой разностью (>1,7 по шкале Полинга) электроотрицательностей, при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью. Ионная связь — крайний случай поляризации ковалентной полярной связи. Образуется между типичными металлом и неметаллом. Ионная связь, в отличие от ковалентной, характеризуется: 1) ненаправленностью, так как сферическое поле вокруг ионов во всех направлениях равноценно; 2) ненасыщаемостью, поскольку при взаимодействии ионов не происходит полной компенсации их силовых полей; 3) координационными числами в ионных соединениях, которые определяются не электронной структурой атомов, а соотношением радиусов взаимодействующих ионов.
Ковалентная связь – образуется посредством общих электронных пар между атомами с одинаковой ЭО или между атомами с небольшой разницей в ЭО, не больше 1.5 единиц. Ковалентная связь образуется между атомами неметаллов.
Если атомы, образующие простую ковалентную связь, одинаковы, то истинные заряды атомов в молекуле также одинаковы, поскольку атомы, образующие связь, в равной степени владеют обобществлённой электронной парой. Такая связь называется неполярной ковалентной связью.
Если атомы различны, то степень владения обобществленной парой электронов определяется различием в электроотрицательностях атомов. Атом с большей электроотрицательностью сильнее притягивает к себе пару электронов связи, и его истинный заряд становится отрицательным. Атом с меньшей электроотрицательностью приобретает, соответственно, такой же по величине положительный заряд. Если соединение образуется между двумя различными неметаллами, то такое соединение называется ковалентной полярной связью.
Ковалентная связь может образовываться двумя способами: посредством общих электронных пар – обменный механизм; по донорно-акцепторному механизму.
Ковалентная связь характеризуется длиной, энергией связи, насыщаемостью и направленностью.
Длина связи - это расстояние между ядрами связанных атомов.
Энергия связи – эта та энергия, которая необходима чтобы данную связь разорвать.
Насыщаемость – определяется валентными возможностями атома, т.е. числом неспаренных электронов и неподеленных электронных пар на внешнем энергетическом уровне.
Направленность – объясняется различным расположением перекрывающихся электронных облаков (их формой и направлением в пространстве) в пространстве и определяет геометрию молекулы. Название гибридных орбиталей определяется числом и типом участвующих орбиталей: sp-, sp2-, sp3- и др. (см. таблицу).
| Орбитали, участвующие в гибридизации | Тип гибридизации | Пространственная форма | Примеры | ||
| s, p | sp | 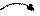 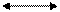 180о
линейная 180о
линейная
| BeCl2, C2H2, [Ag(NH3)2]+ | ||
| s, p, p | sp2 |
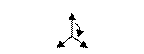
треугольная | BF3, C2H4, NO3- | ||
| s, p, p, p | sp3 | 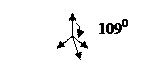 тетраэдрическая
тетраэдрическая
| CH4, [BF4]-, PO43-, [NH4]+ |
Водородная связь – является одним из видов межмолекулярного взаимодействия. Для ее образования необходимо наличие относительно подвижного атома водорода (т.е. связанного сильно полярной ковалентной связью с каким-либо атомом), с одной стороны, и сильно ЭО атомом (т.е. атомом неметалла), имеющим хотя бы одну не поделенную пару электронов, с другой стороны. Водородная связь образуется за счет сил электростатического притяжения полярных молекул, содержащих атомы самых электроотрицательных элементов, таких как F, O, N. Водородные связи могут быть внутри-имежмолекулярными. В белках, нуклеиновых кислотах и других органических соединениях, имеющих большое биологическое значение, водородная связь обеспечивает поперечное сшивание цепочечных молекул.
Металлическая связь – образуется между атомами металлов посредством электронов, которые относительно свободно перемещаются между ядрами атомов. Во всех узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа движутся валентные электроны, отщепившиеся от атомов при образовании ионов. Эти электроны играют роль цемента, удерживая вместе положительные ионы; в противном случае решётка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть. Силы связи не локализованы и не направлены. Поэтому в большинстве случаев проявляются высокие координационные числа (например, 12 или 8). Для металлической связи характерно отсутствие направленности, обусловливающей пластичность металлов.
Date: 2015-09-24; view: 563; Нарушение авторских прав