
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Примеры решения задач. Пример 6.1. При некоторой температуре в системе
|
|
Пример 6.1. При некоторой температуре в системе
N2 (г) + 3Н2 (г) 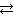 2NH3 (г) равновесные концентрации составляли (моль/л):
2NH3 (г) равновесные концентрации составляли (моль/л):
[N2] = 1,5; [H2] = 1,7; [NH3] = 2,6. Вычислить константу равновесия этой реакции и исходные концентрации азота и водорода.
Решение. Константа равновесия данной реакции выражается уравнением 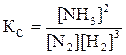 . Подставляя данные задачи, получаем:
. Подставляя данные задачи, получаем: 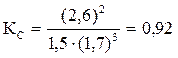 .
.
Исходные концентрации азота и водорода находим на основе уравнения реакции. Согласно уравнению реакции на образование 2 моль NH3 расходуется 1 моль N.2. По условию задачи образовалось 2,6 моль NH3, на что израсходовалось 1,3 моль N2. Учитывая равновесную концентрацию азота, находим его исходную концентрацию: 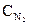 = 1,5 + 1,3 = 2,8 моль/л.
= 1,5 + 1,3 = 2,8 моль/л.
По уравнению реакции на образование 2 моль NH3 необходимо 3 моль H2, а для получения 2,6 моль NH3 требуется 3×2,6 / 2 = 3,9 моль H2. Исходная концентрация водорода 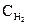 = 1,7 + 3,9 = 5,6 моль/л. Таким образом, КС = 0,92; исходные концентрации
= 1,7 + 3,9 = 5,6 моль/л. Таким образом, КС = 0,92; исходные концентрации 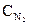 = 2,8 моль/л,
= 2,8 моль/л, 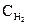 = 5,6 моль/л.
= 5,6 моль/л.
Пример 6.2. Реакция протекает по уравнению А + В 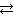 D + F. Определить равновесные концентрации реагирующих веществ, если исходные концентрации веществ А и В, соответственно, равны 2 и 1,2 моль/л, а константа равновесия реакции КС = 1.
D + F. Определить равновесные концентрации реагирующих веществ, если исходные концентрации веществ А и В, соответственно, равны 2 и 1,2 моль/л, а константа равновесия реакции КС = 1.
Решение. Так как все вещества в данной реакции реагируют в одинаковых соотношениях, обозначим изменение концентрации всех реагирующих веществ через x. К моменту установления равновесия образовалось х моль D и х моль F и соответственно [D] = x; [F] = x. По уравнению реакции на столько же уменьшились концентрации А и В, т. е. [A] = 2 – x; [B] = 1,2 – x. Подставим равновесные концентрации в выражение константы равновесия:
КС= 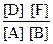 ; 1=
; 1= 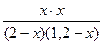 ; х = 0,75.
; х = 0,75.
Отсюда равновесные концентрации: [D] = 0,75 моль/л; [F] = 0,75 моль/л; [A] = 2 – 0,75 = 1,25 моль/л; [B] = 1,2 – 0,75 = 0,45 моль/л.
Пример 6.3. Реакция протекает по уравнению 2SO2 + O2 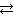 2SO3. В каком направлении сместится химическое равновесие, если объем системы уменьшить в 3 раза?
2SO3. В каком направлении сместится химическое равновесие, если объем системы уменьшить в 3 раза?
Решение. До изменения объема скорости прямой и обратной реакций выражались уравнениями:
vпр =  ; vобр =
; vобр = 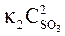 .
.
При уменьшении объема в 3 раза концентрация каждого из реагирующих веществ увеличится в 3 раза. После увеличения концентрации скорость прямой реакции стала: vпр = k1×(3 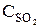 )2×(3
)2×(3 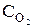 ) = k1× 9
) = k1× 9 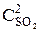 × 3
× 3 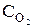 = 27k1
= 27k1 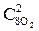
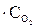 ,
,
т. е. возросла в 27 раз; а скорость обратной – vобр = k2× (3 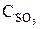 )2 = k2× 9
)2 = k2× 9 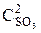 = 9k2
= 9k2 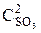 , т. е. возросла в 9 раз. Следовательно, равновесие сместится в сторону прямой реакции (вправо).
, т. е. возросла в 9 раз. Следовательно, равновесие сместится в сторону прямой реакции (вправо).
Пример 6.4. В какую сторону сместится химическое равновесие реакции А + В 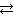 D, если повысить температуру на 30 оС? Температурные коэффициенты скорости прямой и обратной реакции равны соответственно 2 и 3.
D, если повысить температуру на 30 оС? Температурные коэффициенты скорости прямой и обратной реакции равны соответственно 2 и 3.
Решение. При повышении температуры на 30° скорость прямой реакции возрастет в 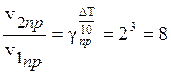 раз, а скорость обратной в
раз, а скорость обратной в 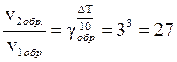 раз. Так как скорость обратной реакции возросла в 27 раз, а скорость прямой в 8 раз, то равновесие этой реакции при повышении температуры сместится в сторону обратной реакции (влево).
раз. Так как скорость обратной реакции возросла в 27 раз, а скорость прямой в 8 раз, то равновесие этой реакции при повышении температуры сместится в сторону обратной реакции (влево).
Пример 6.5. Как изменятся скорости прямой и обратной реакции, если в системе 2NO (г) + О2 (г) 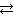 2NO2 (г) уменьшить давление в 2 раза? Произойдет ли при этом смещение равновесия? Если да, то в какую сторону?
2NO2 (г) уменьшить давление в 2 раза? Произойдет ли при этом смещение равновесия? Если да, то в какую сторону?
Решение. До уменьшения давления выражения для скорости прямой и обратной реакции имели вид vпр = k1 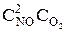 , vобр = k2
, vобр = k2 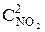 .
.
При уменьшении давления в 2 раза концентрации каждого из реагирующих веществ уменьшаются в 2 раза, так как общий объем системы увеличивается в 2 раза. Тогда
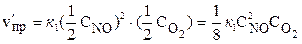 ;
; 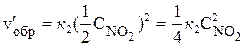 .
.
В результате уменьшения давления скорость прямой реакции уменьшилась в 8 раз, а скорость обратной – в 4 раза. Таким образом, скорость обратной реакции будет в 2 раза больше, чем прямой, и смещение равновесия произойдет в сторону обратной реакции, т. е. в сторону разложения NO2.
Пример 6.6. В каком направлении сместится равновесие реакции
COCl2 ↔ СО + Cl2, ∆H0х.р. = +112,5 кДж а) при повышении давления;
б) с понижением температуры; в) при уменьшении концентрации хлора.
Решение. а) При повышении давления равновесие смещается в сторону реакции, идущей с уменьшением числа молекул газа, при понижении давления – в сторону реакции, идущей с увеличением числа молекул газа. В левой части приведенной реакции 1 молекула (COCl2), а в правой – 2 (1 СО и 1 Cl2), поэтому при повышении давления равновесие смещается в сторону обратной реакции;
б) При понижении температуры равновесие смещается в сторону экзотермической реакции, при повышении температуры – в сторону эндотермической. В нашем примере прямая реакция эндотермическая (∆H0х.р. > 0), а обратная – экзотермическая, следовательно, при понижении температуры равновесие сместится в сторону обратной реакции;
в) При увеличении концентрации исходных веществ и уменьшении концентрации продуктов реакции равновесие смещается в сторону продуктов реакции. При уменьшении концентрации хлора (продукта реакции) равновесие сместится в сторону прямой реакции, т.е. в сторону образования продуктов реакции.
Задачи
№ 6.1. При нагревании диоксида азота в закрытом сосуде до некоторой температуры равновесие реакции 2NO2 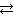 2NO + O2 установилось при следующих концентрациях (моль/л): [NO2] = 0,4; [NO] = 1; [O2] = 0,5. Вычислить константу равновесия для этой температуры и исходную концентрацию диоксида азота. (Ответ: 3,125; 1,4 моль/л).
2NO + O2 установилось при следующих концентрациях (моль/л): [NO2] = 0,4; [NO] = 1; [O2] = 0,5. Вычислить константу равновесия для этой температуры и исходную концентрацию диоксида азота. (Ответ: 3,125; 1,4 моль/л).
№ 6.2. Реакция протекает по уравнению АВ 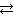 А + В. При некоторой температуре из 1 моль АВ, находящегося в закрытом сосуде емкостью 20 л, разлагается 0,6 моль АВ. Определить константу равновесия. (Ответ: 0,045).
А + В. При некоторой температуре из 1 моль АВ, находящегося в закрытом сосуде емкостью 20 л, разлагается 0,6 моль АВ. Определить константу равновесия. (Ответ: 0,045).
№ 6.3. Константа равновесия реакции N2O4 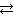 2NO2 равна 0,16 при 375 К. Равновесная концентрация NO2 равна 0,09 моль/л. Вычислить равновесную концентрацию N2O4. (Ответ: 0,051 моль/л).
2NO2 равна 0,16 при 375 К. Равновесная концентрация NO2 равна 0,09 моль/л. Вычислить равновесную концентрацию N2O4. (Ответ: 0,051 моль/л).
№ 6.4. Рассчитать равновесную концентрацию О3 и константу равновесия в реакции 3О2 (г) 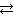 2О3 (г), если начальная масса О2 равна 24 г, а равновесная концентрация О2 равна 0,6 моль/л. (Ответ: 0,1 моль/л; 0,046).
2О3 (г), если начальная масса О2 равна 24 г, а равновесная концентрация О2 равна 0,6 моль/л. (Ответ: 0,1 моль/л; 0,046).
№ 6.5. Используя справочные данные табл. 1 приложения, рассчитать ΔН0х.р. реакции, протекающей по уравнению 2NO2 (г) 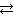 2NO (г) + O2 (г) и определить, в какую сторону сместится равновесие при охлаждении системы.
2NO (г) + O2 (г) и определить, в какую сторону сместится равновесие при охлаждении системы.
№ 6.6. Рассчитать равновесные концентрации газообразных веществ в гетерогенной системе FeO (к) + CO (г) 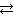 Fe (к) + CO2 (г), если начальная концентрация СО составляла 2 моль/л, константа равновесия КС = 0,6.
Fe (к) + CO2 (г), если начальная концентрация СО составляла 2 моль/л, константа равновесия КС = 0,6.
(Ответ: 1,25 моль/л; 0,75 моль/л.).
№ 6.7. При состоянии равновесия системы N2 + 3H2 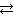 2NH3 концентрации веществ были (моль/л): [N2] = 0,3; [H2] = 0,9; [NH3] = 0,4. Рассчитать, как изменятся скорости прямой и обратной реакции, если концентрации всех участвующих в реакции веществ увеличить в 4 раза. В каком направлении сместится равновесие? (Ответ: 256; 16).
2NH3 концентрации веществ были (моль/л): [N2] = 0,3; [H2] = 0,9; [NH3] = 0,4. Рассчитать, как изменятся скорости прямой и обратной реакции, если концентрации всех участвующих в реакции веществ увеличить в 4 раза. В каком направлении сместится равновесие? (Ответ: 256; 16).
№ 6.8. Вычислить константу равновесия для гомогенной системы:
CO (г) + H2O (г)  СO2 (г) + H2 (г), если равновесные концентрации реагирующих веществ (моль/л): [CO] = 0,004; [H2O] = 0,064; [CO2] = 0,016, [H2] = 0,016. Чему равны исходные концентрации воды и СО?
СO2 (г) + H2 (г), если равновесные концентрации реагирующих веществ (моль/л): [CO] = 0,004; [H2O] = 0,064; [CO2] = 0,016, [H2] = 0,016. Чему равны исходные концентрации воды и СО?
(Ответ: 1; 0,08 моль/л; 0,02 моль/л).
№ 6.9. В начальный момент протекания реакции
NiO (к) + Н2 (г) 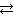 Ni (к) + H2O (г) концентрации были равны (моль/л):
Ni (к) + H2O (г) концентрации были равны (моль/л): 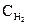 = 0,5;
= 0,5; 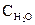 = 1,7. Рассчитать равновесные концентрации газообразных веществ, если КС = 5,66. (Ответ: 0,33 моль/л; 1,87 моль/л).
= 1,7. Рассчитать равновесные концентрации газообразных веществ, если КС = 5,66. (Ответ: 0,33 моль/л; 1,87 моль/л).
№ 6.10. В реакторе при некоторой температуре протекает реакция
СО2 + Н2 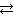 СО + Н2О. Определить константу равновесия, если в начальный момент
СО + Н2О. Определить константу равновесия, если в начальный момент 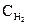 = 2,15 моль/л,
= 2,15 моль/л, 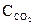 = 1,25 моль/л, а к моменту равновесия прореагировало 60 % начального количества СО2. (Ответ: 0,8).
= 1,25 моль/л, а к моменту равновесия прореагировало 60 % начального количества СО2. (Ответ: 0,8).
№ 6.11. Определить, в какую сторону произойдет смещение равновесия реакции CO2 (г) + 4Н2 (г) 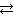 СН4 (г) + 2Н2О (г), ∆Н0х.р = -165 кДж
СН4 (г) + 2Н2О (г), ∆Н0х.р = -165 кДж
при следующих воздействиях: а) увеличении давления; б) повышении концентрации СО2; в) понижении температуры.
№ 6.12. В гомогенной системе установилось равновесие
2H2S + 3O2 ↔ 2SO2 + 2H2O. Константа равновесия КС = 3∙105. Исходные вещества или продукты реакции будут преобладать в равновесной смеси веществ?
Вычислить равновесную концентрацию диоксида серы, если равновесные концентрации веществ, участвующих в реакции, равны (моль/л):
[H2S] = 0,02; [O2] = 0,30; [H2O] = 0,40. (Ответ: 4,5 моль/л).
№ 6.13. Рассчитать КС реакции PCl5 (г)  PCl3 (г) + Cl2 (г) при 500 К, если к моменту равновесия разложилось 54 % PCl5, а исходная концентрация PCl5 была равна 1 моль/л. (Ответ: 0,634).
PCl3 (г) + Cl2 (г) при 500 К, если к моменту равновесия разложилось 54 % PCl5, а исходная концентрация PCl5 была равна 1 моль/л. (Ответ: 0,634).
№ 6.14. После смешивания газов А и В в системе А (г) + В (г)  С (г) +D (г) устанавливается равновесие при следующих концентрациях: [B] = 0,5 моль/л; [C] = 0,2 моль/л. Константа равновесия реакции равна 4×10-2. Найти исходные концентрации вещества А и В. (Ответ: 2,2 моль/л; 0,7 моль/л).
С (г) +D (г) устанавливается равновесие при следующих концентрациях: [B] = 0,5 моль/л; [C] = 0,2 моль/л. Константа равновесия реакции равна 4×10-2. Найти исходные концентрации вещества А и В. (Ответ: 2,2 моль/л; 0,7 моль/л).
№ 6.15. Система С (графит) + СО2 (г)  2СО (г), DН0х.р = 172,5 кДж
2СО (г), DН0х.р = 172,5 кДж
находится в состоянии равновесия. Как повлияет на равновесие системы:
а) повышение температуры; б) понижение давления; в) понижение концентрации СО2?
№ 6.16. При некоторой температуре равновесные концентрации в систеие
2SO2 + O2 = 2SO3 составляли (моль/л): [SO2] = 0,04; [O2] = 0,06; [SO3] = 0,02. Определить константу равновесия и исходные концентрации SO2 и O2.
(Ответ: 4,17; 0,06 моль/л; 0,07 моль/л).
№ 6.17. Реакция протекает по уравнению NO + Cl2 ↔ NOCl2, DН < 0
Какие изменения а) температуры; б) давления; в) концентраций участвующих в реакции веществ способствуют увеличению выхода продукта реакции?
№ 6.18. Константа равновесия реакции FeO (к) + СО (г)  Fe (к) + СО2 (г) при некоторой температуре равна 0,5. Найти равновесные концентрации СО и СО2, если начальные концентрации этих веществ составляли (моль/л):
Fe (к) + СО2 (г) при некоторой температуре равна 0,5. Найти равновесные концентрации СО и СО2, если начальные концентрации этих веществ составляли (моль/л): 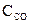 = 0,08;
= 0,08; 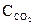 = 0,02. (Ответ: 0,67 моль/л; 0,33 моль/л).
= 0,02. (Ответ: 0,67 моль/л; 0,33 моль/л).
№ 6.19. Система N2 (г) + 3Н2 (г)  2NH3 (г); DН0х.р= -92,4 кДж находится в состоянии равновесия. Определить, в каком направлении сместится равновесие: а) с ростом температуры; б) при повышении давления; в) при понижении концентрации NH3.
2NH3 (г); DН0х.р= -92,4 кДж находится в состоянии равновесия. Определить, в каком направлении сместится равновесие: а) с ростом температуры; б) при повышении давления; в) при понижении концентрации NH3.
№ 6.20. Найти константу равновесия реакции N2O4  2NO2, если начальная концентрация N2O4 составляла 0,08 моль/л, а к моменту наступления равновесия разложилось 50 % N2O4. (Ответ: 0,16).
2NO2, если начальная концентрация N2O4 составляла 0,08 моль/л, а к моменту наступления равновесия разложилось 50 % N2O4. (Ответ: 0,16).
Date: 2015-09-24; view: 2240; Нарушение авторских прав