
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Субстраты и среды
|
|
Используемые в биотехнологии субстраты разнообразны и их спектр непрерывно расширяется. С развитием промышленных процессов происходит накопление новых видов отходов, которые могут быть обезврежены и превращены в полезные продукты методами биотехнологии. В настоящее время наблюдается рост интереса биотехнологов к природным возобновляемым ресурсам - продуктам фотосинтеза, биоресурсам мирового океана.
В состав сред для биотехнологических процессов входят источники углерода и энергии, а также минеральные элементы и ростовые факторы.
Наиболее распространенными источниками углерода при культивировании микроорганизмов являются углеводы (чистые и углеводсо- держащее сырье), спирты, органические кислоты, углеводороды. Довольно часто в качестве источников углеродного питания используют технические виды углеродсодержащего сырья: мелассу, соки растений, патоку, крахмал, сульфитный щелок, барду (продукт переработки спирта), целлюлозу, гидролизаты полисахаридов и древесины. Все эти технические источники углерода чаще всего представляют сложные многокомпонентные смеси различных веществ и служат не только источниками углерода, но и других (необходимых для роста культуры микроорганизмов) химических элементов.
Минеральные элементы, необходимые для роста биологических агентов и входящие в состав питательных сред, подразделяются на макро- и микроэлементы. Среди макроэлементов на первом месте стоит азот, так как потребность в нем у биологических объектов на порядок выше, чем в других элементах (фосфоре, сере, калии и др.). Азот необходим микроорганизмам для обеспечения синтеза нуклеиновых кислот, белков и полимеров клеточной стенки. Источники азота, используемые в промышленном культивировании микроорганизмов также разнообразны. Среди них могут быть простые (аммиак и соли аммония, мочевина), и сложные (кукурузный экстракт, соевая мука, рыбная мука, дрожжевой экстракт и др). Однозначного предпочтения простым или сложным источникам азота отдать нельзя: простые позволяют точно контролировать состав питательной среды и точно задавать содержание в ней азота. Сложные источники азота лучше усваиваются микроорганизмами, но наличие в них неутилизируемых микробной культурой компонентов осложняет дальнейшие стадии технологического процесса и повышает количество отходов, что отрицательно сказывается на экономических показателях технологии.
Минеральные элементы необходимы для роста любого биологического агента, но их концентрация в среде, в зависимости от биообъекта и задач биотехнологического процесса, различна. Обычно она составляет 10"3-10"4 М. Потребности в микроэлементах невелики, и их концентрация составляет 10"6-10"8 М, поэтому микроэлементы часто специально не вносят в среду, так как их примеси в основных солях и воде обеспечивают потребности продуцентов.
Отдельные продуценты нуждаются для роста в наличии в среде ростовых факторов (аминокислот, витаминов и пр.). Помимо чистых индивидуальных веществ такой природы на практике часто используют в качестве ростовых добавок кукурузный или дрожжевой экстракт, картофельный сок, экстракт проростков ячменя, зерновых отходов и отходов молочной промышленности. Добавление ростовых факторов способно увеличить выход целевого продукта в десятки раз. Все указанные выше компоненты питательной среды существенны для культивирования микроорганизмов и эукариотических клеток - иначе их называют биохимическими факторами роста. Существуют также и биофизические факторы роста, к которым относят физические условия, обеспечивающие нормальный рост культуры: это температура культивирования и интенсивность перемешивания, обеспечивающий необходимый массо- обмен в культуре. Различные продуценты имеют определенный диапазон температур, при которых их рост происходит наиболее эффективно.
Однако следует иметь в виду, что оптимальная для роста культуры температура не всегда совпадает с таковой для накопления целевого продукта. Большинство используемых в биотехнологии продуцентов требуют температуры ~ 37 оС (мезофильные микроорганизмы), известны термофильные микроорганизмы, оптимум роста которых находится в диапазоне 70-90 оС, а иногда и выше (>100 оС - экстремальные термофилы). Перемешивание культуры также является важным фактором роста, потому что микробная клетка для своего развития потребляет питательные вещества, в связи с этим вокруг клетки постепенно образуется пространство с пониженной концентрацией этих веществ, так что возникает градиент концентрации питательных веществ. Со временем этот градиент начинает лимитировать рост клетки и всей культуры. Наиболее эффективным способом преодоления возникающих проблем является обеспечение эффективного массообмена в культуре, что и достигается путем перемешивания.
Традиционно состав питательной среды, оптимальной для каждого биотехнологического процесса, определяется методом длительного эмпирического подбора, но в последние 20 - 25 лет все шире используется математический метод планирования экспериментов, математическое моделирование биотехнологических процессов - это позволяет обоснованно подходить к конструированию питательных сред, сделать их экономичными.
Конструирование питательных сред для выращивания
микроорганизмов
Многие нетребовательные микроорганизмы, например бактерия Escherichia coli) хорошо растут на среде очень простого состава. Такая среда называется минимальной (синтетической).
Таблица 3.2
| KH2PO4 | 0,5 г |
| NH4C1 | 1,0 г |
| MgSO4 7H2O | 0,2 г |
| CaCl2 | 0,01 г |
| FeSO4 7H2O | 0,01 г |
| Глюкоза | 10,0 г |
| Раствор микроэлементов | 1 мл |
| Вода | 1000 мл |
Иногда минимальной среды недостаточно для нормального роста микроорганизмов. В этом случае в состав среды вводят добавки, предварительно установив, в каких из них нуждается данный микроорганизм. Для многих почвенных бактерий используют смесь витаминов, которые добавляют в количестве 2-3 мл на 1000 мл минимальной среды - такая среда будет называться сложной (комплексной).
Таблица 3.3 Состав смеси микроэлементов________________________
| Биотин | 0,2 мг |
| Никотиновая кислота (витамин РР) | 2,0 мг |
| Тиамин (В1) | 1,0 мг |
| п-Аминобензойная кислота | 1,0 мг |
| Пантотеновая кислота | 0,5 мг |
| Пиридоксамин (В6) | 5,0 мг |
| Цианкобаламин (В12) | 2,0 мг |
| Дистиллированная вода | 100 мл |
При выделении микроорганизмов из природных источников часто появляется необходимость проводить культивирование таким образом, чтобы размножались преимущественно клетки определенного вида микроорганизмов. В таких случаях используется метод накопительных культур, предложенный Виноградским и Байеринком. Для подобных ситуаций часто приходится составлять специальные среды, называемые элективными. Проводя несколько кратковременных пассажей на такой среде, можно получить чистую культуру целевого микроорганизма.
Технология приготовления питательных сред
Питательная среда для культивирования микроорганизмов должна удовлетворять двум основным требованиям: 1) она должна содержать все необходимые для роста компоненты; 2) не должна содержать примесей каких-либо микроорганизмов, т. е. должна быть стерильной.
Технология стерилизации питательных сред включает ряд разнообразных приемов. Главным и наиболее традиционным является термическая стерилизация - прогревание среды при высоких температурах, когда большинство микроорганизмов погибают (см. рис. 3.6). Для большинства микроорганизмов достаточным оказывается кипячение среды (~100 оС). Обычно среду прогревают при более высокой температуре, для чего нагревание проводят при повышенном давлении (3-5 атм.; избыточное давление). Для небольших количеств среды используют автоклавы, а при стерилизации больших объемов сред обработку проводят прямо в ферментаторе «острым» паром - струей сильно перегретого пара с температурой 130-140 оС.
Пастеризация как вариант термической стерилизации. В случае спорообразующих микроорганизмов термическая стерилизация непригодна, так как. споры микроорганизмов обладают исключительно высокой термостабильностью, поэтому используют метод пастеризации, получивший свое название от имени выдающегося ученого второй половины прошлого века Луи Пастера - одного из основателей современной микробиологии. Сущность этого метода заключается в том, что среду прогревают при относительно невысокой температуре (~60 оС), затем охлаждают и цикл повторяют несколько раз. Микроорганизмы (вегетативные формы) при этих условиях погибают, а споры остаются жизнеспособными. После охлаждения стерилизуемой среды до нормальной для роста температуры, споры прорастают и микроорганизмы переходят в стадию вегетативной культуры, после чего повторное прогревание вызывает их гибель.
Стерилизация фильтрацией. Часто приходится использовать питательные среды сложного состава, не выдерживающие термической стерилизации. Например: глюкоза при повышенной температуре «карамелизуется», раствор темнеет из-за образования полимерных продуктов распада. Ясно, что в таких случаях необходимо использовать щадящие методы стерилизации, такие, как фильтрация. Фильтрация также известна со времен Пастера. Часто в качестве фильтров используют негла- зурованные фарфоровые фильтры (свечи Шамберлана), в настоящее время применяют фильтр Беркефельда (из прессованного кизельгура), асбестовые пластины, стеклянные и мембранные фильтры. Современная технология изготовления мембран позволяет изготавливать мембраны с заданным размером пор. Стерилизация фильтрацией является одним из процессов так называемой мембранной технологии, которая используется не только для стерилизации, но и для фракционирования сложных смесей. При всех положительных качествах стерилизующей фильтрации через мембраны нельзя не отметить и недостатки этого способа, к которым относятся: адгезия частиц к мембранам, неоднородность пор по диаметру, удержание части стерилизуемой дорогостоящей жидкости на мембране при фильтрации малых объемов ее, а также возможная селективная адсорбция ионов (чаще - катионов) из небольших объемов растворов, недостаточная или плохая смачиваемость мембран водой и др.
|
Другие способы стерилизации включают облучение УФ-светом, рентгеновскими и g-лучами. Также используют химические методы, например, обработку b-пропиолактоном, окисью этилена и др. Наиболее часто применяют b-пропиолактон, его добавляют к готовой питательной среде в концентрации 0,2 %. В течение двух часов при температуре 37 оС все микроорганизмы погибают. После выдерживания среды в течение ночи b-пропиолактон полностью гидролизуется, и среда становится пригодной к использованию.

|
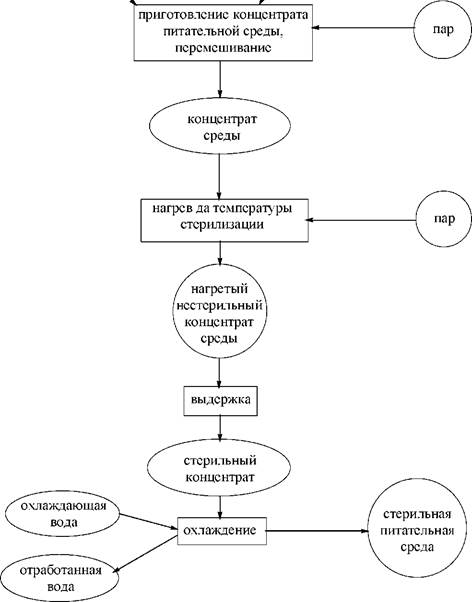 Рис. 3.6. Принципиальная схема процесса приготовления и тепловой стерилизации питательной среды
Рис. 3.6. Принципиальная схема процесса приготовления и тепловой стерилизации питательной среды
|
Date: 2015-09-24; view: 2083; Нарушение авторских прав