
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Свойства растворов неэлектролитов
|
|
Осмотическое давление, давление пара, изменение температуры замерзания и кипения подчиняются законам Вант-Гоффа и Рауля.
Осмотическое давление раствора неэлектролита определяют согласно закону Вант-Гоффа:
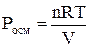 ,
,
где n – количество растворенного вещества, моль; V – объем раствора, м3; R – газовая постоянная, равная 8,31 Дж/(моль·К); Т – температура, К. Заменив n выражением m/M, где m – масса растворенного вещества, г; M – его молярная масса, г/моль, получим
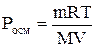 ,
,
или, исходя из определения молярной концентрации, получим:
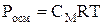 .
.
Понижение температуры замерзания и повышение температуры кипения растворов по сравнению с температурой замерзания и температурой кипения чистого растворителя определяют по II закону Рауля:
Dtзам. = Кк×Сm; Dtкип. =Кэ×Cm,
где Dtзам. и Dtкип. – соответственно понижение температуры замерзания и повышение температуры кипения раствора находят по формуле
Dtзам = Тзам. р-ля – Тзам. р-ра ; Dtкип= Ткип. р-ра – Т кип. р-ля;
Кк и Кэ – соответственно криоскопическая и эбулиоскопическая константы растворителя; Сm – моляльная концентрация раствора (моль/кг) может быть найдена по формуле
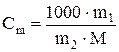 ,
,
где m1 – масса растворенного вещества, г; М – его молярная масса, г/моль; m2 – масса растворителя, г.
Растворы замерзают (из раствора кристаллизуется растворитель) при температуре более низкой, чем чистый растворитель. Если приготовить раствор из 1 000 г растворителя и 1 моля неэлектролита, то числовое значение уменьшения температуры замерзания такого раствора называют молярным понижением температуры кристаллизации данного растворителя (или криоскопической константой) KK. Криоскопическая константа воды составляет 1,86 Сo, это значит, что растворы, содержащие 1 моль любого неэлектролита в 1 000 г воды начинают замерзать при температуре – 1,86 oC.
Растворы кипят при температуре более высокой, чем чистые растворители. Если приготовить раствор из 1 000 г растворителя и 1 моль неэлектролита, то числовое значение увеличения температуры кипения такого раствора называют молярным повышением температуры кипения данного растворителя (или его эбулиоскопической константой) KЭ. Эбулиоскопическая константа воды равна 0,52 К; это значит, что растворы, содержащие 1 моль любого неэлектролита на 1 000 г воды, закипают при 100,52 oC.
Определив опытным путем повышение температуры кипения или понижение температуры кристаллизации растворов, концентрации которых нам известны, можно вычислить молярную массу вещества или молекулярную массу вещества (молекулярная масса выражается тем же числом, что и молярная масса, но имеет размерность а.е.м.).
Данные по криоскопическим и эбулиоскопическим константам приведена в табл.7 приложения.
Date: 2015-09-24; view: 995; Нарушение авторских прав