
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Термодинамические расчеты в энергосбережении
Самым простым и распространенным путем получения из топлива тепла является сжигание топлива. Как правило, сжигание топлива проводят в воздухе, в котором содержание кислорода составляет около 21% об. Все реакции горения любых видов топлива в кислороде являются экзотермическими, т.е. протекание таких реакций сопровождается выделением тепла. Тепловой эффект реакции зависит от условий, в которых протекает реакция горения. Поэтому тепловые эффекты при постоянном объеме или постоянном давлении различны. Выделяющееся тепло реакции, если она проводится при постоянном давлении, называют энтальпией и обозначают АН.
Например, реакцию сжигания углеводородного топлива общей формулы СnHm в кислороде (02) до углекислого газа (С02) и воды (Н20) в химической термодинамике принято записывать следующим образом:
v1 СnHm + v202 => v3CO2 + v 4H2O + ΔН (1)
где vi - стехиометрические коэффициенты.
Законы Г. И. Гесса
Количество тепла, которое можно получить из топлива, вычисляют согласно термохимическим законам Г.И. Гесса. На основе экспериментальных данных было установлено, что тепловой эффект химической реакции не зависит от пути (механизма) реакции, а определяется только природой и состоянием исходных реагентов и конечных продуктов реакции.
В соответствии с законами Гесса, теплота любой химической реакции ( ΔН ) равна сумме теплот образования конечных продуктов ( vПi ΔНобр )П за минусом суммы теплот образования исходных веществ ( vИi ΔНобр )И
ΔН =∑( vПi ΔНобр )П -∑ ( vИi ΔНобр )И (2)
Для сопоставления протекания различных реакций используют стандартные значения теплоты образования соединений. Стандартной теплотой образования соединения называют теплоту реакции образования одного моля конкретного соединения из простых веществ в стандартных условиях и обозначают символом ( ΔНоТобр ). Теплота образования из простых веществ для углеводородов означает образование из углерода (С) и водорода (Н2). Стандартные значения теплоты образования различных соединений содержатся в специальных справочниках. В них для температуры 298К (25°С) и давления 1 атм приведены стандартные значения теплоты образования разнообразных химических соединений и органических топлив, которые обозначаются символом ( ΔНо298обр ).
Зависимость теплоты реакции от температуры
Большинство данных по теплоте реакций, приведенных в справочной литературе, относится к температуре 298К. Для расчета энтальпии (теплового эффекта) реакции при другой температуре используют уравнение Кирхгофа интегральном виде:
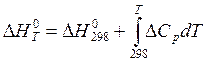 (3)
(3)
где  - изменение теплоемкости при постоянном давлении в интервале температур от 298К до Т.
- изменение теплоемкости при постоянном давлении в интервале температур от 298К до Т.
Из уравнения видно, что для определения теплового эффекта реакции при температуре Т, необходимо знать его величину при другой температуре, например, при 298К, и зависимость теплоемкостей реагентов и продуктов реакции в температурном интервале от 298К до Т.
Теплоемкость вещества - это физическая величина, характеризующая способность вещества увеличивать свою температуру при нагреве. Теплоемкость вещества при постоянном давлении (Ср) выражается отношением энтальпии к температуре (дифференциальное уравнение Кирхгофа):
 (4)
(4)
и численно равна количеству тепла, которое необходимо для нагревания единицы массы вещества на 1 градус. Наиболее употребительной единицей измерения Ср является кал/моль-град или Дж/моль град.
Теплоемкость i-го вещества зависит от температуры. Поэтому в термохимических и теплотехнических расчетах используют либо экспериментальные значения СР для различных температур, либо проводят ее расчет по уравнению:
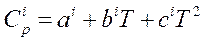 (5)
(5)
где a, b, с - коэффициенты уравнения зависимости теплоемкости от температуры. Значения коэффициентов уравнения приведены в справочниках.
Теплоемкость при постоянном давлении
При протекании химической реакции исходные реагенты превращаются в продукты реакции, в результате чего происходит изменение теплоемкости (ΔСp):
ΔСp = ∑(υПiСp) П - ∑(υИiСp) И (6)
Очевидно, что изменение теплоемкости ΔСpтакже можно представить в виде уравнения вида:
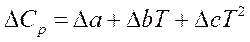 (7)
(7)
где 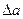 ,
,  ,
, 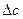 - алгебраическая сумма соответствующих коэффициентов уравнений вида (5) для исходных реагентов и продуктов реакции с учетом стехиометрических коэффициентов для продуктов (υПi) и исходных реагентов (υИi) соответственно.
- алгебраическая сумма соответствующих коэффициентов уравнений вида (5) для исходных реагентов и продуктов реакции с учетом стехиометрических коэффициентов для продуктов (υПi) и исходных реагентов (υИi) соответственно.
После подстановки уравнения (4) в (2) и интегрирования в пределах от 298К до Т с учетом (7) получим выражение (8):
 (8)
(8)
Достаточно часто для проведения оценочных расчетов вместо достаточно громоздкого уравнения (8) используют выражение (9):
 (9)
(9)
со средней теплоемкостью 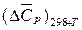 в интервале температур 298К ÷ Т.
в интервале температур 298К ÷ Т.
Для оценочных расчетов в качестве 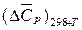 можно использовать среднее арифметическое значение теплоемкостей при температурах 298К и Т.
можно использовать среднее арифметическое значение теплоемкостей при температурах 298К и Т.
Таким образом, для расчета энтальпии (теплоты) химической реакции сжигания топлива при температуре Т необходимо знать: теплоемкости реагентов и продуктов реакции при температурах 298К и Т; энтальпию (теплоту) реакции при температуре 298К.
Date: 2015-09-24; view: 529; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |