
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Окислительно-восстановительные реакции
Пример 1. Исходя из степеней окисления хрома и селена, определите, какие из веществ (К2СrO4, Cr, Cr2O3, Na2Cr2O7, SeO3, Na2Se, Se) в процессе ОВР могут проявлять: а) только окислительные свойства; б) только восстановительные свойства; в) как окислительные, так и восстановительные свойства?
Решение. Только окислительные свойства могут проявлять вещества, содержащие атомы элемента в высшей степени окисления. Высшая степень окисления хрома (VI B-подгруппа, валентные электроны 3d54s1) и селена (VI A-подгруппа, валентные электроны 4s24p4) равна +6, так как атом каждого из этих элементов может отдать 6 электронов. Такая степень окисления имеется в K2CrO4, Na2Cr2O7, SeO3.
Только восстановительные свойства могут проявлять вещества, содержащие атомы элемента в низшей степени окисления. До образования устойчивой электронной структуры 4s24p6 у атома селена не хватает двух электронов, которые он может принять, поэтому низшая степень окисления селена равна –2. Этому соответствует Na2Se. Металлы, к которым относится и хром, могут только отдавать электроны, но не могут их принимать. Поэтому низшая степень окисления хрома равна нулю, т. е. это металлический хром Cr0.
В соединениях 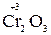 , Se0 степени окисления хрома и селена промежуточные, поэтому возможны и окислительные, и восстановительные свойства.
, Se0 степени окисления хрома и селена промежуточные, поэтому возможны и окислительные, и восстановительные свойства.
Пример 2. ОВР протекают по схемам:
1) FeSO4 + К2Cr2О7 + H2SO4  Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O
Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O
2) К2МnО4 + Н2О  КMnО4 + МnО2 + КОН
КMnО4 + МnО2 + КОН
Для каждой реакции укажите: а) окислитель и восстановитель; б) какое вещество окисляется, какое вещество восстанавливается. Составьте электронные уравнения и на их основании расставьте коэффициенты в уравнениях реакций.
Решение. 1) В схеме реакции расставим изменяющиеся степени окисления:



Определим характер процессов:

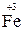 – увеличение степени окисления; процесс окисления;
– увеличение степени окисления; процесс окисления;

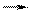
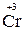 – уменьшение степени окисления; процесс восстановления.
– уменьшение степени окисления; процесс восстановления.
 – восстановитель,
– восстановитель,  – окислитель.
– окислитель.
В данной реакции окислитель и восстановитель различные вещества. Такие реакции называются межмолекулярными.
Составляем электронные уравнения:
 – процесс окисления;
– процесс окисления;
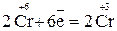 – процесс восстановления.
– процесс восстановления.
(Коэффициенты удваиваем, так как в каждом моль K2Cr2O7, Cr2(SO4)3, Fe2(SO4)3 содержатся по два моль  соответственно).
соответственно).
Поскольку число электронов, отдаваемых восстановителем, должно равняться числу электронов, принимаемых окислителем, умножим электронные уравнения на соответствующие коэффициенты:

Подставляем эти коэффициенты в схему реакции
6FeSO4 + K2Cr2O7 + H2SO4 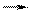 3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O
3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O
Находим подбором и расставляем остальные коэффициенты
6FeSO4 + K2Cr2O7 + 7H2SO4  3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
Окончательная проверка правильности написания уравнения проводится по балансу атомов кислорода.
6·4 + 7 + 7·4 = 3·3·4 + 3·4 + 4 + 7,
59 = 59.
2) В результате аналогичных действий получим:


– процесс окисления;
– процесс восстановления.
Здесь и окислителем, и восстановителем является атом одного и того же элемента в промежуточной степени окисления, содержащийся в одной и той же молекуле ( в К2МnО4). ОВР такого типа называются реакциями диспропорционирования.
в К2МnО4). ОВР такого типа называются реакциями диспропорционирования.
Date: 2015-09-24; view: 855; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |