
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Всего 30 баллов. 1. Речь идет о реакции получения аммиака: N2 + 3H2 ⇄ 2NH3
|
|
Решение.
1. Речь идет о реакции получения аммиака: N2 + 3H2 ⇄ 2NH3. Этот процесс реализуется в производстве синтетического аммиака.
2. Скорость химической реакции при постоянной температуре пропорциональна произведению концентраций реагирующих веществ.
Для реакции, записанной в общем виде аА + bB +... ® сС + dD +..., в соответствии с законом действующих масс зависимость скорости от концентрации реагирующих веществ может быть представлена в виде v = k[А]vА[В]vВ. Здесь k - коэффициент, не зависящий от концентрации, называемый константой скорости; vA и vB - постоянные числа, называемые показателями порядка реакции по реагентам А и В. Сумма vA + vB = v называется суммарным (общим) порядком реакции. Представленная зависимость - математическое выражение закона действующих масс для скорости.
В отличие от закона действующих масс для равновесия, в данном случае показатели порядка vA и vB по реагентам почти никогда не равны стехиометрическим коэффициентам а и b (совпадение бывает только в одном случае - если реакция представляет элементарный акт!). Для сложных реакций показатели порядка реакции никогда не равны стехиометрическим коэффициентам и определяются только экспериментально.
В обратимых реакциях скорость прямой реакции вначале имеет максимальное значение, а затем уменьшается вследствие уменьшения концентрации исходных веществ. И наоборот, обратная реакция в начальный момент имеет минимальную скорость, которая увеличивается по мере нарастания концентрации продуктов реакции. Наконец, наступает такой момент, когда скорости прямой и обратной реакции становятся равными.
Выражения для скоростей прямой и обратной реакций для реакции mА + nB ⇄ pC + qD, v1 = k1[А]m[В]n, v2 = k2[C]p[D]q.
3. Состояние, в котором скорость обратной реакции становится равной скорости прямой реакции, называется химическим равновесием. Состояние химического равновесия обратимых процессов количественно характеризуется константой равновесия K. Так, для обратимой реакции, которую в общем виде можно записать как mА + nB ⇄ pC + qD, в момент достижения состояния химического равновесия скорости прямой и обратной реакций равны, т.е.
k1[А]m[В]n = k2[C]p[D]q или K = k1/k2 = ([C]p[D]q)/([А]m[В]n).
где K - константа равновесия, представляющая собой отношение констант скорости прямой и обратной реакций. В правой части уравнения стоят те концентрации взаимодействующих веществ, которые устанавливаются при равновесии - равновесные концентрации. Это уравнение представляет собой математическое выражение закона действующих масс при химическом равновесии.
В отличие от закона действующих масс для скорости реакции в данном случае в уравнении показатели степени р, q, n, m ит.д. всегда равны стехиометрическим коэффициентам в равновесной реакции.
Численное значение константы равновесия данной реакции определяет ее выход. Так, при K >> 1 выход реакции велик и, наоборот, при K << 1 выход реакции очень мал.
4. а) если увеличить давление в реакторе, равновесие сместится в сторону, где давление будет ниже, в случае реакции синтеза аммиака – в сторону образования продукта реакции NH3, выход продукта реакции увеличится.
б) добавление дополнительного количества катализатора не будет влиять на выход продукта реакции, катализатор ускоряет достижение состояния равновесия, т.е. ускоряет и прямую и обратную реакции.
5. Поскольку реакция N2 + 3Н2(Г) ⇄2NH3(Г) + 91,8 кДж экзотермическая, то, исходя из принципа Ле Шателье, ясно, что чем ниже температура процесса, тем больше равновесное состояние будет сдвигаться в сторону образования аммиака и можно предположить, что следует максимально понижать температуру. Но в действительности все обстоит сложнее: при низких температурах реакция протекает очень медленно (практически не идет), поэтому приходится принимать компромиссное решение. Поскольку для установления оптимального состояния равновесия реакции требуется низкая температура, а для достижения удовлетворительной скорости - высокая, на практике процесс проводят при температуре 500°С.
6. Промышленный способ получения азотной кислоты:
а) 4NH3 + 5O2 = 4NO + 6Н2O (800°С, кат. Pt/Rh),
б) 2NO + O2 = 2NO2 (комн.).
в) 4NO2 + O2 + 2Н2O (разб. HNO3, гор.) = 4HNO3 (конц.).
7. Другие соединения азота с водородом: гидразин - N2H4 и азидоводород - HN3.
| N2H4 | HN3 |
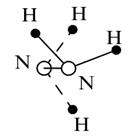
| 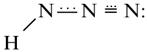
|
Азот образует и другие соединения с водородом. Кроме вышеуказанных соединений можно рассмотреть
азаны – ациклические соединения азота с водородом с общей химической формулой NnHn+2,
азены - производные нестойкого диазена (диимида) HN=NH с общей химической формулой NnHn,
циклические соединения азота с водородом.
Например:
триазан N3H5 (NH2-NH-NH2), тетраазан, N4H6; пентаазан, N5H7; гексаазан, N6H8; и т.д.
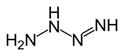
триазен N3H3 (HN=N–NH2), тетразен N4H4 (цис -, транс -NH2-N=N–NH2 или NH2-NН-N=NH), и т.д.
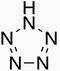
пентазол, циклическое ароматическое соединение HN5.
| N3H6 | N4H4 | HN5 |
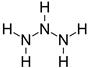
| 
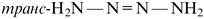
| 
|
Можно привести еще множество структур азота с водородом, однако они либо не получены, либо крайне неустойчивы.
Date: 2015-09-24; view: 977; Нарушение авторских прав