
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Всего 20 баллов
|
|
Решение.
1. Определим состав смеси оксидов:
Na2O + 2HCl = 2NaCl + H2O,
CaO + 2HCl = CaCl2 + H2O,
SiO2 + HCl =/= реакция не идет.
Нерастворившийся остаток - SiO2. m(SiO2) = 54 г, n(SiO2) = 54/60 = 0,9 моль.
Масса Na2O + CaO составляет 71,70 – 54 = 17,70 г.
Пусть n(Na2O) = х моль, n(СаО) = у моль. Тогда n(NaCl) = 2х моль, n(CaCl2) = у моль.
Составляем систему уравнений:
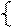 62х + 56у = 17,70
62х + 56у = 17,70
58,5·2х + 111у = 34,20
Решением системы является: х = 0,15; у = 0,15; n(Na2O) = 0,15 моль, n(СаО) = 0,15 моль.
В растворе фторидной кислоты протекают реакции:
Na2O + 2HF = 2NaF + H2O,
CaO + 2HF = CaF2 + H2O,
SiO2 + 6HF (конц.) = H2[SiF6] + 2H2O.
n(HF) = 0,15·2 + 0,15·2 + 0,9·6 = 6 моль. m(HF) = 6·20 = 120 г.
m(HF)Р-Р = 120/0,4 = 300 г.
2. Температуры кипения в ряду галогенводородов HCl - HBr - HI последовательно возрастают, что объясняется ростом массы и размеров молекул, из-за чего усиливается межмолекулярное взаимодействие и, как следствие, повышаются температуры плавления и кипения. Однако для HF значения температур плавления и кипения, полученные экстраполяцией в ряду однотипных соединений HF – НСl – НВr – HI, оказываются существенно ниже найденных экспериментально. Аномально высокие температуры плавления и кипения фтороводорода объясняются усилением межмолекулярного взаимодействия за счет образования водородных связей между молекулами HF. Твердый фтороводород состоит из зигзагообразных полимерных цепей. В жидком и газообразном HF вплоть до 57°С присутствуют олигомеры от (HF)2 до (HF)6. Для НСl, HBr, HI образование водородных связей не характерно из-за меньшей электроотрицательности атома галогена.
3. Жидкий HF состоит из полимерных цепей (HF)n различной длины, а также некоторого количества димеров H2F2 и, возможно, циклических тетрамеров H4F4 и гексамеров H6F6. В отличие от воды фрагменты (HF)n не образуют трехмерного каркаса, поэтому он обладает меньшей вязкостью по сравнению с водой. Жидкий фтороводород проводит электрический ток, что объясняется равновесием 3HF ⇄ H2F+ + HF2-.
Высокая диэлектрическая проницаемость жидкого фтороводорода (e = 83,6 при 0°С), низкая вязкость и широкий температурный интервал жидкою состояния делают его хорошим неводным растворителем для большого числа соединений.
Образованием водородных связей объясняется существование кислых фторидов (или гидрофторидов), не имеющих аналогов среди солей, производных других галогеноводородных кислот. В гидрофторидах, например в NH4HF2 анион HF2- содержит два иона фтора, соединенных симметричной водородной связью, т.е. оба расстояния Н-F в группировке F···H-F одинаковы. Это довольно редкое явление: как правило, водородные связи не симметричны.
Гидрофториды имеют относительно низкую температуру плавления. Так, KHF2 плавится при ~200°С, а средняя соль KF - при ~700°С. Низкая температура плавления гидрофторидов ЩЭ - причина их практической важности для технологии. Например, при электролизе расплавов фторидов с целью получения молекулярного фтора экономически целесообразно использовать KHF2 или KH2F3, а не KF.
4. Причиной отсутствия у фтора кислоты состава HГОn и неустойчивости кислородных соединений фтора, как и всех галогенов, является принадлежность обоих партнеров по химической связи к числу наиболее электроотрицательных элементов ПС. Именно фтор (4,1) и кислород (3,5) имеют самое высокое значение электроотрицательности, что обостряет их конкуренцию за электронную плотность при образовании связи F-О и делает эту связь непрочной.
Положение усугубляется еще и тем, что фтор не способен образовывать кратные связи, в том числе с кислородом, из-за отсутствия у фтора свободных орбиталей, и поэтому кислород не может, реагируя со фтором, реализовать свою склонность к двоесвязанности. К тому же одинарные ковалентные связи, в которые вступает кислород (например, связь О-О в Н2О2), непрочны. Реагируя с другими соседями по периоду, тоже высокоэлектроотрицательными азотом и углеродом, кислород образует с ними кратные связи, благодаря наличию у N и С не полностью занятых электронами 2р–орбиталей. Это объясняет значительно большую прочность кислородных соединений азота и углерода по сравнению с такими же соединениями галогенов, особенно фтора.
5. В степени окисления +7 хлор образует кислоту НСlO4, бром - НВrO4, иод - Н5IO6. Структура Н5IO6 в отличие от НСlO4 построена из октаэдров (НО)5IO, связанных между собой водородными связями Н-О×××О в трехмерный каркас. Известны и другие йодные кислоты: мета- НIO4, мезо- Н3IO5 и трииодная Н7IO7, также построенные из октаэдров (НО)5IO, соединенных друг с другом в бесконечные цепи.
Общая формула гидроксидов – Э–(ОН) Х, где х – степень окисления элемента. Максимальное значение х = 8, однако координационные сферы с большим числом гидроксогрупп неустойчивы. Повышение устойчивости достигается путем уменьшения координационного числа за счет отщепления одной или нескольких молекул воды. Чем выше степень окисления элемента, а следовательно, меньше размер иона, тем большее число молекул воды отщепляется для обеспечения устойчивости координационной сферы. Если для гидроксида хлора устойчивой является структура Сl(ОН)7 – 3Н2О = НСlO4, для гидроксида иода характерно увеличение количества связанных гидроксоанионов, что обусловлено достаточно большим атомным радиусом иода. Для р-элементов 5-го периода вообще характерны более богатые водой гидратные формы. Так, наряду с Н2ТеО4 известна и ортотеллуровая кислота Н6ТеО6 (Те(ОН)6 без потери молекул воды), а для иода кроме НIО4 известна и Н5IО6 с потерей всего 1 молекулы воды от гидроксида номинального состава I(ОН)7.
6. При нагревании до 1200°С, а затем охлаждении до комнатной температуры исходной смеси оксидов образуется стекло. Na2O + СаО + 6SiO2 –(t°)® Na2O·СаО·6SiO2.
Стекло представляет собой однородную систему, аналогичную истинному раствору. Это переохлажденная жидкость с «замороженной» структурой. Иногда стекла называют аморфными веществами, но в отличие от настоящих аморфных веществ в них имеется некоторая упорядоченность в расположении кремнекислородных тетраэдров. Однако структура стекла, в отличие от структуры кристалла, не симметрична и не периодична, поэтому стекла рентгеноаморфны.
Стекла представляют собой неравновесные системы, поскольку образуются путем переохлаждения расплавов. Запас энергии стеклообразной системы больше, чем кристаллической, поэтому в благоприятных температурных условиях стекла способны к кристаллизации. Чем больше способность к самопроизвольной кристаллизации, тем более быстрое охлаждение приходится применять, чтобы перевести расплав в стеклообразное состояние.
Стеклообразное состояние является промежуточным между кристаллическим и жидким. Стекла, в отличие от кристаллических веществ, не имеют определенной температуры плавления и затвердевают постепенно.
Основу структуры силикатного стекла составляют тетраэдры [SiO4]. Как и в кристаллических силикатах, они связаны друг с другом через общие кислородные атомы. В стекле каждый атом имеет определенное число ближайших соседей, т.е. содержатся те или иные структурные единицы. Однако структурная единица регулярно не повторяется. В натриевом стекле ионы натрия размещаются в пустотах стеклообразной структуры, преимущественно вблизи от атомов кислорода, связанных только с одним атомом кремния. Таким образом компенсируется координационная ненасыщенность последних. Каждый ион натрия окружен в среднем шестью атомами кислорода. Ионы натрия в каркасе стекла распределены статистически.
4. Неметалл Б образует с кислородом соединения, в которых величины mО/mБ относятся как 0,57:1,14:1,71:2,28:2,85:3,42.
1) Укажите закон, который описывает это отношение, и величину, которой кратны цифры отношения (2 балла).
2) Расшифруйте вещества и приведите структуры и формулы соединений, в которых:
валентность и степень окисления одинаковы,
валентность больше степени окисления,
валентность меньше степени окисления (12 баллов).
3) Укажите класс неорганических соединений, к которым можно отнести эти вещества (3 балла)
4) Приведите реакции получения только тех соединений, которые образуются при взаимодействии Б с О2 или уже полученных соединений Б с О2 (3 балла).
Date: 2015-09-24; view: 702; Нарушение авторских прав