
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Лабораториялық сабақ тақырыптары
|
|
| Апта | Лабораториялық сабақтың тақырыптары | сағаты |
| Модуль 1. Негізгі топша элементтері | ||
| Газдарға байланысты зертханалық тәжірибелер | ||
| Ерітінділер дайындау | ||
| Галогендер тақырыбына эксперименттік тәжірибе жүргізу | ||
| Металдар тақырыбына эксперименттік тәжірибе жүргізу | ||
| Бейорганикалық қосылыстардың кластарына сапалық реақциялар | ||
| Электролиттік диссоциациалану теориясы тақырыбына эксперименттік тәжірибе жүргізу | ||
| «Ион алмасу» тақырыбына эксперименттік тәжірибе жүргізу | ||
| Модуль 2. Қосымша топша элементтері | ||
| Негізғі катиондар мен аниондарға сапалық реакциялар | ||
| «Оттегі» топшасы элементтеріне эксперименттік тәжірибе жүргізу | ||
| «Азот» топшасы элементтеріне эксперименттік тәжірибе жүргізу | ||
| І және ІІІ топшасы элементтеріне эксперименттік тәжірибе жүргізу | ||
| Сілтілік металдар және кальций элементтеріне эксперименттік тәжірибе жүргізу | ||
| «Темір» топшасы элементтеріне эксперименттік тәжірибе жүргізу | ||
| Органикалық химиядан эксперименттік тәжірибе жүргізу | ||
| Сарамандық сандық есептер шығару |
СӨЖ тапсырмалары
Апта
Тақырыбы Негізгі химиялық түсініктер мен химия заңдары.
1. Химиядағы зат мөлшері. Мольдік көлем..
2. Химиялық реакциялар қалай жіктеледі? Мысалдар.
3. Газдардың молекулалық массасын қалай есептейді?
4. Газ заңдары. Менделеев-Клапейрон теңдеуі
5.Бейорганикалық қосылыстардың негізгі кластары және олардың жіктелуі, алыну жолдары.
6. Бейорганикалық кластардың генетикалық байланысына мысал келтірңдер.
7. Глоссарий. Химия, зат, химиялық реакция, оксидтер, қышқылдар, негіздер, тұздар, қоршаған орта
8. Лабораториялық сабақта берілген тапсырмаларды орындап, қорғау кажет.
3- апта Атом құрылысы және периодтық заң
1.Атомның құрылымдық бөлімдері – ядро (протондар, нейтрондар), электрондар, олардың заряды мен салмағы.
2. Электронның корпустық-толқынды табиғаты.
3. Электронның энергетикалық деңгейлері мен деңгейшелерінің максималды саны.
4. Атомдардың электрондардың қабықшаларының толу реті. Клечковский ережелері.
5. Атомдар мен иондар радиусы. Атомдардың иондану энергиясы.
6. А және В топшаларының айырмашылығы неде?
7. Төмендегі кестеден әр студент өз нұсқасындағы элементтерді алып, электрондық формуласын жазып, соңғы энергетикалық қабатының квант сандарын жазыңдар
| Нұсқа | ||||||||||||
| Элемент-тер | Na | K | Ca | Mg | AI | Si | Ti | Cr | Mn | Fe | Co | Cu |
| C | N | O | F | Ne | P | S | CI | Ar | Br | Kr | B |
9. Глоссарий: атом, ядро, электрон, атомдық орбиталь, квант саны.
10. Лабораториялық сабақта берілген тапсырмаларды орындап, қорғау кажет.
Апта
Тақырыбы: Химиялық байланыс.
1. Химиялық байланыстың қандай түрлері бар?
2. Коваленттік байланыс түзілу механизмін түсіндіріңдер.
3. Химиялық байланыстың қандай сипаттамалары бар?
4. Донорлы – акцепторлы әрекеттесуге мысал келтіріңдер.
5. Иондық байланыстың түзілу механизмін түсіндіріңдер.
6. Сутектік, металдық байланыстарға мысал келтіріңдер.
9. Тапсырма:
- молекуладағы әрбір атомның валенттік электрондарының атомдық орбитальдарына
орналасуын көрсетіңіз;
- байланыс түрін анықтаңыз;
2 тапсырма:
- молекуланы түзетін атомдардың электрондык формуласын жазыңыз
Бастапқы мәліметтердің кестесі
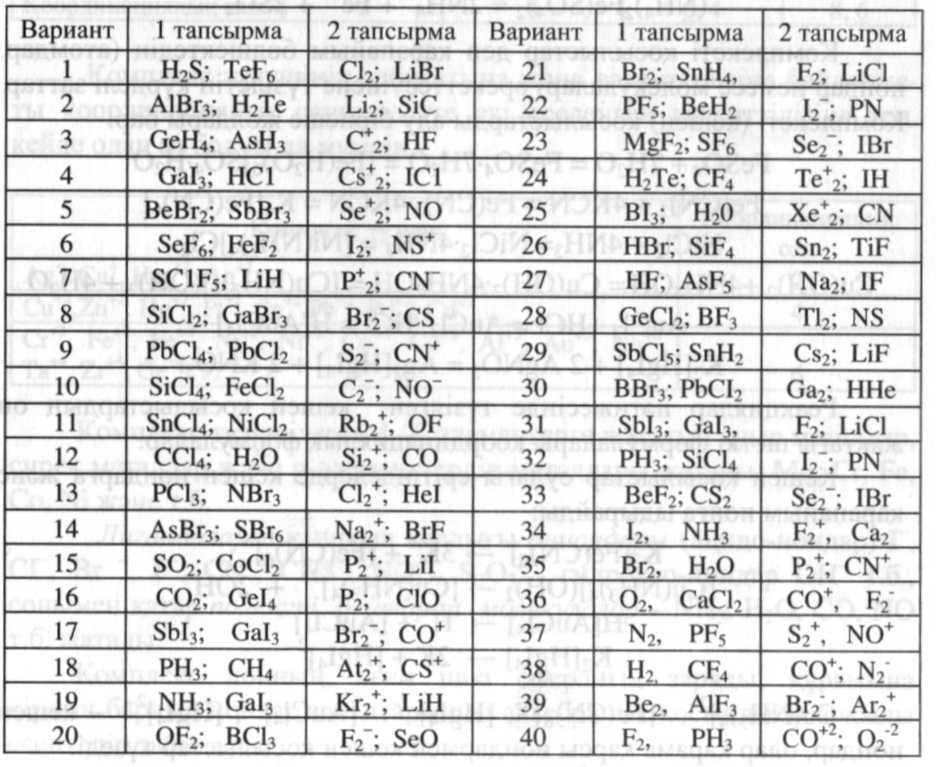
7. Глоссарий: валенттік электрон, ион, байланыс энергиясы, байланыс ұзындығы, электртерістілік, донор, акцептор.
8.Лабораториялық сабақта берілген тапсырмаларды орындап, қорғау кажет
5 –апта Химиялық термодинамиканың элементтері
1. Химиялық термодинамикадағы: жүйелер, үрдістер, параметрлер, функциялар түсініктері.
2. Термодинаиканың заңдары.
3. Термохимиядағы Гесс заңы бойынша есептеулер қалай жүргізіледі?
4. Энтальпия мен энтропия ұғымын қалай түсіндіріңдер. Гиббс энергиясы.
5. Гиббстің бос энергиясы бойынша реакция бағытын анықтау
6.Химиялық рекциялардың жылдамдығына қандай факторлар әсер етеді?
7. Егер реакцияның температуралық коэффициенті 2 тең, ал температура 800-тан 1200С-қа дейін өзгерсе, реакция жылдамдығы неше есе артады?
8. 2NO2(г) ↔ 2NO(г) + O2(г) жүйедегі белгілі бір температурада келесі концентрацияларда тепе-теңдік орнады [NO2] = 0,06 моль/л; [NO] = 0,24 моль/л; [O2] = 0,12 моль/л. Тепе- теңдік константасын есептеңдер.
9.Глоссарий: термодинамика, энтальпия, энтропия, химиялық тепе-теңдік, концентрация, температура, катализатор.
10.Лабораториялық сабақта берілген тапсырмаларды орындап, қорғау кажет.
6 –апта Химиялық реакция жылдамдығы. Химиялық тепе-теңдік
1. Гомогенді және гетерогенді жүйедегі реакциялар жылдамдығы қалай анықталады?
2. Реакция жылдамдығына қандай факторлар әсер етеді?
3. Вант-Гофф ережесінің формуласы қандай?
4. Гомогенді және гетерогенді катализге мысалдар.
5. Катализаторлар. Тізбекті реакциялар.
6. Гомогенді және гетерогенді жүйелердегі химиялық тепе-теңдік тұрақтылығы.
7. Химиялық тепе-теңдіктің ығысуы Ле-Шаталье принципін түсіндір.
9. Глоссарий: тепе-теңдік, концентрация, температура, қысым, катализатор
10.Лабораториялық сабақта берілген тапсырмаларды орындап, қорғау кажет.
Апта
Тақырыбы: Ерітінділердің жалпы қасиеттері
1.Ерітінділердің концентрациясын өрнектеудің қандай тәсілдері бар?
2.Қандай ерітінділер қаныққан деп аталады?
3.Көп қолданылатын еріткіш және оның сипаттамасын келтір.
4.Заттардың ерігіштігі қандай факторларға тәуелді?
5.Ерітінділердің физика-химиялық теориясының негізін қалаған ғалым және теорияның мәні қандай?
6. Заттың эквиваленттік факторы қалай есептеледі?
7. 2 л 0,05м ерітінді дайындау үшін қанша грамм натрий гидроксиді қажет?Жауабы: 4 г
8. 2 л суда 8,0 г натрий гидроксиді ерітілді. Алынған ерітіндінің мольдік концентрациясын анықтау керек. Жауабы: 0,1 М
9. 4.250 г суда 50 г FeSO4 * 7H2O кристаллогидраты ерітілген. Ерітіндідегі сусыз темір(II) сульфатының проценттік концентрациясын есептеңіз.
10.10 % сілті ерітіндісін алу үшін NaOH 30 % ерітіндісінің 200 мл (ρ = 1,33 г/мл) қанша су қосу керек?
11. 5% H2SO4 (ρ = 1,10 г/мл) ерітіндісінің 10 мл дайындау үшін 96% ерітіндінің (ρ = 1,84 г/мл) және судың қандай массасын алу керек
12. Глоссарий: концентрация, титр, ерітіндінің қайнау және қату температуралары, бу қысымы
13.Лабораториялық сабақта берілген тапсырмаларды орындап, қорғау кажет.
8-апта Тақырыбы: Электролиттердің сулы ерітінділері.
1. Әлсіз және күшті электролиттерге мысалдар келтіріңдер.
2. Электролиттің константасы және диссоциациялану дәрежесі дегеніміз не?.
3. Тұздар гидролизінің 3 жағдайына мысалдар келтіріңдер.
4. Табиғатта кездесетін тотығу-тотықсыздану процестеріне мысал келтіріңдер.
5. Тотықтырғыштар мен тотықсыздандырғыштарға мысалдар келтіріңдер.
6. Төмендегі заттардың электролиттік диссоциация теңдеулерін жазыңыз.
ҒеСІ3, АІ(NO3)3, Ва(ОН)2, Н3РО4, Н2SO4, NаОН
Қай жағдайда диссоциация сатылап жүреді?
7. рН – 5 және рН–12 ерітінділерінің Н+,ОН- иондарының концентрацияларын есептеңдер.
8.Глоссарий: электролит, иондану дәрежесі, иондану константасы, гидролиз, сутектік көрсеткіш, ерігіштік, ерігіштік көбейтіндісі
9.Лабораториялық сабақта берілген тапсырмаларды орындап, қорғау кажет.
9- апта Тотығу-тотықсыздану реакциялары (ТТР)
1.ТТР негізгі түсініктері: тотығу дәрежесі, тотықтырғыштар, тотықсыздандырғыштар, эквивалент массалары 2. Қандай заттар тотығу-тотықсыздану екідайлылығын көрсетеді? Мысал келтіріңіз.
3. ТТР теңдеулерін құру үшін қандай әдістер қолданады?
4. Ионды-электрондық әдіс қандай ережеге негізделген?
5. ТТР жүруіне қандай факторлар әсер етеді?
6. Кең қолданатын тотықтырғыш және тотықсыздандырғыштарды атаңыз.
7. Жаттығулар орындау
Элементтердің келесі реакциялар нәтижесінде соңғы тотығу дәрежелерін көрсетіп, коэффициенттерін қойыңыз.
1) Cu(NO3)2(қ) CuO(қ) + NO2(г) + O2(г)
2) Br2(ер) + KOH(ер) KBr(ер) + KBrO(ер) + H2О
3)(NH4)2Cr2O7(қ) Cr2O3 (қ) + N2(г) + H2O
4) Cl2(ер) + I2(қ) + H2O HIO3(ер) + HCl(ер)
5) NO2( (г) + H2O HNO3 (ер)+ N2O3(с)
6) Na2SO3(қ) Na2S(қ) + Na2SO4(қ)
7) Cl2(ер) + KOH(ер) KCl(ер) + KClO(ер) + H2O
8) NaNO2(ер) + Br2(ер) + H2O NaNO3(ер) + HBr(ер)
9) MnO2 + HCl = MnCl2 + Cl2 + H2O
10) К2Cr2O7 + HCI = CrCI3 + CI2 + H2O + KCI
11) CuS + Н2SO4 + H2O2 = CuSO4 + S + Н2О
12) KNO2 + 2HNO3 + PbO2 = KNO3 + Pb(NO3)2 + H2O
13) H2S + HNO3 = S + 2NO + 4H2O
14) Na2SO3 + HNO3(конц.) = Na2SO4 + NO2 + H2O
15) Си + НNO3 Cu(NO3)2 + NO2 + Н2O
16) Н3Р04+2НІ = НзРОз + І2 + Н 2 0
17) H3P03 + SnCl2 + H 2 0 = 2HCH-Sn + H 3 P 0 4
18) H3P03+Pb(N03)2 + H 2 0 = Pb+2HN03 + H3P04
19) H3P03+2AgN03 + H 2 0 = 2Ag+2HN03+H3P04
20) КМпО4 + Nа2SO3 + Н2SO4 = МпSO4 + Nа2SO4 + К2SO4 + Н2О
Тотықтырғыш пен тотықсыздандырғышты көрсетіңдер.
9.Глоссарий: тотығу дәрежесі,тотығу, тотықсыздану, тотықтырғыш, тотықсыздандырғыш
10.Лабораториялық сабақта берілген тапсырмаларды орындап, қорғау кажет
10- апта Комплексті қосылыстар
1 Комплексті қосылыстар қалай жіктеледі?
2. Комплексті қосылыстардың номенклатурасы, мысал келтіріңдер.
3. Лигандтар дегеніміз қандай қосылыстар? Қандай типтері бар?
4. Кешенді қосылыстардың электрондық құрылымының сипатын түсіндіріңдер.
5. Комплексті қосылыстың ішкі сферасы қандай бөлшектерден тұрады?
6. Келесі қосылыстардың формулаларын құрастырыңдар:
А) гексанитрокобальтат (ІІІ) ионы
В) темір (ІІІ) гексацианоферраты
С) аквапентахлороферрат (ІІІ) ионы
7.Координациялық сан төртке тең болатын комплексті иондар формуласын Си2+ жазыңыз. Лигандтар. Н2О, СІ-, СN-, S2О32
9. Глоссарий: комплексті қосылыстар, комплекс ион, комплекстүзуші, лиганд, координациялық сан.
10. Лабораториялық сабақта берілген тапсырмаларды орындап, қорғау
11-апта. s – элементтер
1.Топшада бір типтес қосылыстардың қышқылдық –негіздік қасиеттерінің өзгеруін сипаттаңдар.
2. Сутегінің периодтық системада орналасу орны.
3.Сілтілік металдар атомдарының электрондық құрылысына байланысты химиялық қасиеттері қалай өзгереді?
4. Берилий - радий қатарында металдардың қасиеттері қалай өзгереді?
5. Берилий мен магний атомдарының электрондық конфигурациясын жазыңдар және валенттілігін анықтаңдар.
6. Судың кермектілігін қалай анықтайды?
7. ВеСІ2 электрондық құрылысын және геометриялық құрылымын жазып көрсетіңдер
8. Калийдің тетрагидроксобериллатының және натрий тетрафторобериллатының формулаларын жазыңдар.
10. Глоссарий: сілтілер,тотықсыздандырғыш қасиет, кермектілік, комплексон.
11. Лабораториялық сабақта берілген тапсырмаларды орындап, қорғау
12-апта. р - элементтер (ІІІА, ІVА, VА)
1. р-элементтерінің электрондық құрылысы
2. р-элементтерінің ұқсастықтары мен айырмашылығы қандай?
3. ІІІ топтың негізгі топшасының элементтерінің атом құрылыстарының қандай ерекшеліктері бар?
4. Алюминий атомының электрондық конфигурациясын жазыңдар және валенттілігін анықтаңдар.
5.Бор мен кремнийдің химиялық қасиеттерінде қандай ұқсастық бар?
6.Көміртектің аллотропиялық модификацияларының құрылысы.
7. Көміртектің сутекті және оттекті қосылыстары.
8. Азоттың сутекті және оттекті қосылыстары.
9. Фосфордың аллотропиялық модификациялары.
10. Фосфордың сутекті және оттекті қосылыстары.
9. Лабораториялық сабақта берілген тапсырмаларды орындап, қорғау кажет.
13-апта р - элементтер (VІА, VІІА)
1.VІА тобы элементтерінің тотығу дәрежелері. Табиғатта таралуы.
2.Озон, оның алынуы, қасиеттері.
3.Су. Судың кермектілігі. Сутек пероксиді.
4. Молекулалық оттектің тотықтырғыш қасиетіне мысал келтіріңдер.
5. Күкірттің сутекті және оттекті қосылыстары.
6. Галогендердің атом құрылысы бойынша хлор, хлор, бром, иодқа қандай валентті күйлер тән?
7.VІІА тобы элементтерінің жалпы сипаттамасы, алынуы, қасиеттері және оның қосылыстарының қолданылуы.
8.Хлор мен иодтың оттекті қышқылдары. Оттекті қышқылдардың тұздары.
9. Жаттығу орындау
Төменде берілген сызба-нұсқалардың реакция теңдеулерін жазыңдар:
1) NaI → NaBr → NaCI → CI2 → KCIO3 → KCI → AgCI
2) S → SO2 → H2SO3 → NaHSO3 → Na2SO3 → Na 2SO4 → BaSO4
10. Лабораториялық сабақта берілген тапсырмаларды орындап, қорғау кажет.
14-15 апта d-элементтердің хииялық қасиеттері
1. d -элементтерінің комплекс ион түзу механизмі.
2. Хромның тотығу дәрежелері.
3.Хромның оксидтері, гидроксидтері мен қышқылдары
4. Марганец оксидтері: марганец диоксиді, марганец (ҮІІ) оксиді.
5.Марганец қосылыстарының қатысында тотығу-тотықсыздану реакцияларына ортаның әсері.
6.Темір, кобальт, никельдің бір типті қосылыстарының қасиеттерін салыстыру
7.Мыс, күміс, алтынның оттекпен және галогендермен қосылыстары.
8.Мырыш, кадмий, сынаптың оттекпен, галогендермен, күкіртпен қосылыстары..
10.Лабораториялық сабақта берілген тапсырмаларды орындап, қорғау кажет.
Бақылау жұмысы №1
1.Ерітіндінің массалық үлесін есептеңіз:
| Нұсқа | ||||||||||||
| mзат | ||||||||||||
| mерітінді | - | - | - | - | - | - | ||||||
| mсу | - | - | - | - | - | - |
2.Белгісізді табыңыз
| Нұсқа | ||||||||||||
| nмоль | ? | ? | ? | ? | ? | |||||||
| mг | ? | ? | ? | ? | ? | |||||||
| Мг/моль | ? | ? | ? | |||||||||
| Vл | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
3.Вант –Гофф ережесі бойынша есептеңіз:
| Нұсқа | ||||||||||||
| Dt | ? | ? | ? | ? | ||||||||
| g | ? | ? | ? | ? | ||||||||
| ut2/ut1 | ? | ? | ? | ? |
4. Келесі реакция теңдеулерінің химиялық тепе-теңдік константаларын математикалық түрде жазыңдар
1) 2H2+O2↔2H2O
2) 4NO2+O2↔2N2O5
3) 2CO+O2↔2CO2
4) N2+3H2↔2NH3
5) P2O3+O2↔P2O5
6) 4P+5O2↔2P2O5
7) S+O2↔SO2
8) 2N2+5O2↔2N2O5
9) 2SO2+O2↔2SO3
10) СІ2 + 7О2 ↔2СІ2O7
11) Н2 + О2 ↔ 2Н2О
12) С + СО2 ↔ 2СО
Date: 2015-09-24; view: 4616; Нарушение авторских прав