
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

lt; 6s 4f 5d < 6p < 7s
|
|
2. Принцип запрета Паули. На одной АО могут находиться не более
чем два электрона, которые должны иметь различия спиновые, маг-
нитные квантовые числа m s (направления спинов
должны быть противоположными).
3. Правило Хунда. АО заполняются электронами так, чтобы их сум-
марный спин был максимальным.
4. Правило Клечковского. При переходе от одного элемента к другому электроны размещаются последовательно на орбиталях, расположен-
ных в порядке возрастания суммы главного и орбитального квантовых чи-
сел (n+e). При одинаковых значениях этой суммы первой заполняется ор-
биталь с меньшим значением главного квантового числа.
Электронная конфигурация атома - распределение электронов по
атомным орбиталям в соответствии с правилами заполнения.
Все атомы характеризуются индивидуальным набором спектральных ли-
ний электромагнитной шкалы.
Энергией ионизации (Э.И.) называется энергия, которую необходимо
затратить для отрыва электрона от атома, часто ее приводят в электро- вольтах, тогда ее называют потенциалом ионизации (П.И.).
Сродство к электрону (С.Э.)- энергия, выделяемая при присоенении
электрона к атому, характеризует способность атома образовывать отри-
цательно заряженные ионы.
Электроотрицательность (Э.О.)- условная величина, характеризующая
способность атома в химическом соединении притягивать к себе электроны.
Важнейшей характеристикой атома является размер, атомный радиус, из-
меряемый в сантиметрах (1А= 10-8см)
Все атомы одного и того же элемента имеют одинаковое число протонов
и, следовательно, одинаковый заряд ядра, но могут содержать различное количество нейтронов, а значит, и различное массовое число.
Такие атомы называют изотопами. Следовательно, изотопы- это атомы одного и того же химического элемента, отличающиеся друг от друга содержанием нейтро-
нов в ядре. Например, водород имеет такие изотопы: H-протий (Z=1, A=1), D-дейтерий (Z=1, A=2) и Т-тритий (Z=1, A=3). Почти все химические элементы состоят из нескольких изотопов, которые делятся на две группы: Ста-
бильные и радиоактивные. Ядра стабильных изотопов вполне устойчивы, ядра
радиоактивных изотопов самопроизвольно распадаются, превращаясь в ядра
других элементов.
Явления радиоактивности- процесс самопроизвольного распада ядер некоторых элементов. При 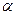 -распаде испускается
-распаде испускается 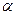 -частица (ядро
-частица (ядро  ), заряд ядра уменьшается на
), заряд ядра уменьшается на 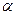 , массовое число на
, массовое число на  , образуется элемент, расположенный в периодической системе на две клетки левее. При
, образуется элемент, расположенный в периодической системе на две клетки левее. При 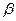 - распаде испускается электрон, заряд ядра увеличивается на 1, массовое число не изменяется, образуется элемент расположенный в периодической системе на клетку правее. При
- распаде испускается электрон, заряд ядра увеличивается на 1, массовое число не изменяется, образуется элемент расположенный в периодической системе на клетку правее. При  - распаде или К- захвате испускается позитрон или захватывается электрон с ближайшей к ядру соответственно, заряд ядра уменьшается, массовое число не изменяется, образуется элемент, расположенный в периодической системе на одну клетку левее.
- распаде или К- захвате испускается позитрон или захватывается электрон с ближайшей к ядру соответственно, заряд ядра уменьшается, массовое число не изменяется, образуется элемент, расположенный в периодической системе на одну клетку левее.
Контрольные вопросы
1. Написать уравнение реакций взаимодействия соединений Zn(OH)2, Sn(OH)2 и Al(OH)3, с избытком раствора гидроксида натрия. Назвать получаемые гидроксокомплексы.
2. В 200 мл воды растворили 20 г нитрата калия. Определите массовую долю (%) KNO3.
3. Каждую массу (г) 15%-ного раствора CaCl2 можно приготовить, имея 170 мл воды?
4. В 175 мл воды растворим 25 г CuSO4*5H2O. Какова массовая доля (%) CuSO4 в полученном растворе?
5. Какая масса (г) NH4Cl в 2 л 0,1 м NH4Cl?
6. В 200 мл воды растворили 5,6 л хлороводорода (н.у.). Определить массовую долю (%) HCl в полученном растворе.
7. Растворы каких веществ необхожимо взять, чтобы получить в осадке гидроксид никеля (II)? Написать молекулярное и ионное уравнения этого процесса.
8. Вычислить концентрацию [OH-] при pH 4,7.
9. Какие из перечисленных солей не гидролизуются: K3PO3, Al2(SO4)3, NaNO3, CaCO3, Cr2S3?
10. Какой характер среды имеет раствор цианида аммония NH4CN, если KNH4OH = 1,8*10-5, KHCN = 7,2*10-10?
Контрольные вопросы
2. Напишите электронные и электронно-ячеечные формулы валентных электронов атомов следующих элементов в основном и возбуждённом состояниях, определите высшую и низшую степени окисления, приведите формулы оксидов в высшей степени окисления элемента;
2.1 p-элемент VI периода IV группы
2.2 p-элемент V периода V группы
2.3 p-элемент V периода VII группы
2.4 d-элемент IV периода VII группы
2.5 p-элемент III периода IV группы
2.6 p-элемент III периода VI группы
2.7 s-элемент V периода I группы
2.8 p-элемент IV периода V группы
2.9 p-элемент IV периода IV группы
2.10 d-элемент IV периода III группы
2.11 s-элемент III периода II группы
2.12 p-элемент IV периода VII группы
2.13 d-элемент VI периода V группы
2.14 s-элемент V периода II группы
2.15 p-элемент V периода IV группы
2.16 d-элемент V периода VI группы
2.17 p-элемент III периода VI группы
2.18 d-элемент IV периода VI группы
2.19 p-элемент III периода V группы
2.20 d-элемент V периода IV периода
Контрольные вопросы
1. Что такое относительная масса. Рассчитать относительную массу серы, если m(S) = 5,3*10-23 г, а m (С) = 2,0 *10-23 г.
2. Рассчитать абсолютную массу молекулы серной кислоты, если её относительная молекулярная масса М2 равна 98.
3. Относительная плотность газа по водороду, содержащего 27,27% углерода и 72,73% кислорода, равна 22. Определить относительную молекулярную массу газа и его химическую формулу.
4. При растворении в кислоте 3,06 г металла выделилось 2,8 л водорода, измеренного при н.у. Вычислите молекулярную массу эквивалента металла.
5. При нагревании 20,06 г металла было получено 21,66 г оксида. Определить молярную массу эквивалента металла, если молярная масса эквивалента кислорода равна 8 г/моль.
6. Определить, какой это металл, если 1,6 г кальция и 2,615 г двухзарядного металла вытесняют из кислоты одинаковый объём водорода при одних и тех же условиях.
7. Определить молярную массу эквивалента металла, если при сгорании 7,2 г металла в хлоре получилось 28,2 г соли. Молярная масса эквивалента хлора равна 35,45 г/моль.
8. Хлорид металла содержит 69% хлора. Относительная атомная масса металла равна 47,9. Определить степень окисления металла в этом соединении.
Date: 2015-09-24; view: 746; Нарушение авторских прав