
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Строение атома и радиоактивность
|
|
Основные понятия и законы химии
2.
Основой химии является атомно-молекулярное учение. Химическому элементу соответствует атом, соединениям молекула.
Атом -наименьшая частица химического элемента, сохраняющая все его химические свойства. Химические свойства атома определяются его строением.
Молекула- наименьшая частица данного вещества, обладающая его химическими свойствами. Химические свойства молекулы определяются его составом и химическим строением. Молекула состоит из атомов.
Молекулярная масса (М)- масса молекулы выраженная в атомных единицах массы. Молекулярная масса равна сумме атомных масс всех атомов, из которых состоит молекула.
Моль- количество вещества, содержащее столько же структурных единиц (атомов, молекул, ионов, и т. д), сколько содержится атомов углерода в 0,012 (12 г) изотопа углерода -12 (молярная масса г/моль численно равна молекулярной массе).
Закон сохранения массы (Ламоносов. Лавуазье).
Общая масса реагентов равна общей массе продуктов реакции. Для уравнения реакции:
aA+bB=AaBb
закон сохранения массы можно записать в следующем виде:
m(A) + m(B)=m(AaBb), или в общем виде: 
Закон кратных отношений (Дальтон). Если два элемента образуют друг с другом несколько химических соединений, то на одну и ту же массу одного
их них приходится те же массы другого, которые относятся между собой как простые целые числа.
Закон постоянства состава (Пруст). Всякое чистое вещество, независимо от способа его получения, всегда имеет постоянный качественный и коли- чественный состав.
Последующее развитие химии показало, что существует соединения как постоянного, так и переменного состава. По предложению а пад. Н.С. Курианова первые названы дальтонидами (в память Дальтона), вторые- бертоллидами (в память французского химика Бертолле, предвидевшего такие соединения). Состав дальтонидов выражается простыми формулами с целочисленными стехиометрическими индексами, например,H2O, HCI, CH4,
C6H6. Состав бертоллидов изменяется и не отвечает стехиометрическим от-
ношениям; у бертоллидов дробные стехиометрические индексы. Так, оксид титана(II) TiO в действительности имеет состав с TiO0,7 до TiO1,3 (в зависи- мости от условий синтеза).
Закон эквивалентных отношений (Рихтер). Массы реагирующих веществ относятся между собой как молярные массы их эквивалентов.

где mA, mB –массы реагирующих веществ, эА, эВ –их химические экви- валенты.
Химическим эквивалентом элемента называется такое его количество, которое соединяется с 1 моль атомов водорода или замещает то же коли- чество атомов водорода в химических реакциях.
Между молекулярной массой М, молярной массой эквивалента Э и валент-
ностью В элемента А существует соотношение


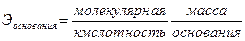
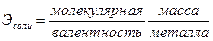
Закон Авогадро. В равных объемах любых газов при одинаковых условиях содержится одинаковое число молекул. Молекулы простых газов двухатомные (H2,O2,N2).
1 моль- 22,4 л- 6,023…. молекул (NA) (где NA-число авагадро) при нормальных условиях (273,15к, 101,325кПа)
Уравнение Менделеева - Клайперона

где Р- давление газа, Па: V- его объем м3
m- масса вещества, г; М- его мольная масса г/моль Т- абсолютная температура, К; R- универсальная газовая постоянная, равная 8,314 Дж/(моль.к).
Строение атома и радиоактивность.
Атом - наименьшая частица химического элемента, обуславливающая его
свойства. Атом- электронейтральная микросистема, состоящая из положительно заряженного ядра и электронных оболочек, на которых рас-
пологаются электроны. В ядре сосредоточена почти вся масса атома. Ядро
состоит из протонов и нейтронов (общее название их- нуклоны). Число протонов, электронов и нейтронов (N) связаны с зарядом ядра Z (заряд
электрона- -1,602*10-19. Кл или -1 а.е.з, заряд протона- +1,602*10-19 Кл или +1 а.е.з)
и массовым числом А (атомная масса) следующим соотношениям:
N=A - Z
Атомная единица массы (а.е.м) – величина, точно равная одной двенадцатой части (1/12) массы атома изотопа углерода-12 равна
1,9932*10-28 кг, аюеюм равна 12,000
1 а.е.м=1,661*10-27 кг
Атомную массу всех химических элементов сравнивают с (а.е.м и получают численные значения относительных атомных масс.
Любое устойчивое состояние электрона в атоме характеризуется определен- ными значениями квантовых чисел n, e, m и s:
n- главное квантовое число, характеризующее энергию электрона и размер
электронного облака, принимает значение 1, 2, 3…+ 
e- побочное (орбитальное) квантовое число, характеризующее геометрию орбитали, принимает значения 0, 1, 2, 3…n-1
m- магнитное квантовое число, характеризующее геометрию орбитали,
принимает значения от- е…о…+е
s - спин электрона, характеризует собственный магнитный момент электро- на, связанный с движениями электрона относительно “собственной оси”, принимает значения …..
Состояние электрона в атоме, отвечающее определенным значениям кван-
товых чисел называется атомной электронной орбиталью.
Правила заполнения атомных орбиталей (АО)
1. Принцип наименьшей энергии. В первую очередь заполняются
электронами АО с наименьшей энергией. Порядок
расположения АО по энергии:
1 s< 2s < 2p < 3 s < 3p < 4s 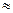 3d< 4p < 5s
3d< 4p < 5s 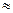 4d < 5p <
4d < 5p <
Date: 2015-09-24; view: 751; Нарушение авторских прав