
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Электрохимические процессы
|
|
1. Процессы превращения энергии химической реакции в электрическую – это процессы, протекающие в гальванических и топливных элементах.
2. Процессы превращения электрической энергии в химическую – это процессы, протекающие при прохождении постоянного тока через раствор или расплав (электролиз).
Понятие об электродном потенциале
Рассмотрим электродную систему: металлический электрод, погруженный в электролит – раствор соли.
1. При погружении достаточно активных металлов (Zn, Fe и др.) в водный раствор на их поверхности происходит взаимодействие ионов металла с диполями воды. В итоге ионы металла гидратируются и переходят в раствор, а электроны остаются в металле и заряжают пластину металла отрицательно. Ионы металла остаются в прилежащем слое раствора около поверхности металла. В результате образуется двойной электрический слой, кторый можно уподобить конденсатору.
Рис.24. Возникновение двойного электрического слоя на границе Zn – раствор.
[ Zn2+... 2e ] + m H2O = Zn2+× m H2O
кристалл ¯ гидратированный ион
остаются в кристаллич. решетке,
нескомпенсированный отрицат. заряд
Сокращенно: Zn0 – 2e = Zn2+
По мере увеличения концентрации ионов металла в растворе у его поверхности, выход их из металла уменьшается, а вероятность обратного процесса возрастает. Устанавливается подвижное динамическое равновесие. Возникшая на границе металл-раствор в условиях равновесия разность потенциалов называется равновесным электродным потенциалом системы Е (Men+/Me).
Активные металлы (цинк, железо и др.) продолжают посылать свои ионы даже в концентрированные растворы своих солей и всегда заряжаются отрицательно – их называют электроотрицательными, а скачок потенциала на границе металл-раствор условно считается отрицательной величиной, например, Zn - 2e = Zn2+, E (Zn2+/Zn) < 0.
2. При погружении малоактивных металлов, например, меди, в раствор своей соли (CuSO4), не ионы меди переходят в раствор, а наоборот, часть катионов из раствора переходит на медный электрод, заряжая его положительно.Раствор же около поверхности металла за счет избытка анионов SO42- имеет избыточный отрицательный заряд. На границе металл-раствор возникает двойной электрический слой. Металлы, которые извлекают свои ионы из сколь угодно разбавленных растворов своих солей и всегда заряжаются положительно, называют электроположительными.
Рис.25. Возникновение двойного электрического слоя на границе Cu - раствор
Cu2+ + 2e = Cu, E (Cu2+/Cu) > 0
3. Среди электроположительных металлов особое положение занимает платина, которая никогда, ни при каких условиях не посылает своих ионов в раствор (очень прочная кристаллическая решетка). Наоборот, она может извлекать любые катионы из раствора, а ее кристаллическая решетка служит как бы резервуаром электронов, и на поверхности платины протекают процессы типа:
Fe3+ + e = Fe2+ или Sn2+ - 2e = Sn4+
В этом случае потенциал, возникающий на границе металл-раствор, будет определяться свойствами ионов, участвующих в данном процессе, например, Е (Fe3+/Fe2+) > 0, E(Sn4+/Sn2+) > 0.
Такие электродные системы называются редокси-электродами (Red – восстановленная форма, Ox - окисленная форма).
4. Если платину покрыть платиновой чернью (слоем мелкодисперсной платины), то она приобретает свойства растворять и атомизировать газы (водород, кислород). Если платину погрузить в раствор кислоты и насытить газообразным водородом, то на границе раздела пойдет процесс:
Н2 Û 2Н - 2е Û 2Н+, Е(2Н+/Н2)
Равновесный потенциал такой системы при стандартных условиях (р = 101,3 кПа, Т = 298К, активная концентрация ионов водорода в растворе серной кислоты 1 моль/л) принимают условно равным нулю, а саму систему называют стандартным водородным электродом: Е0(2Н+/Н2) = 0 вольт.
Этот электрод устойчив в работе и имеет хорошо воспроизводимый потенциал.
ВЫВОДЫ: на границе металл-раствор возникает двойной электрический слой – электродный
потенциал. Абсолютное значение этого равновесного потенциала измерить нельзя. Можно
измерить или рассчитать относительные значения потенциалов.
Нормальный или стандартный окислительно-восстановительный (ОВ) потенциал.
Относительный потенциал любой электродной системы можно рассчитать по измеренному значению ЭДС гальванического элемента, составленного из искомого электрода и стандартного, потенциал которого условно известен.
Потенциал любой электродной системы, находящейся при стандартных условиях (р=101,3 кПа, Т=298К, активные концентрации всех ионов в растворе 1 моль/л), и измеренный относительно стандартного водородного электрода, называется нормальным или стандартным ОВ-потенциалом, и обозначается ± Е° (Ox/Red), вольт (или j°).
Ox – окисленная форма,
Red – восстановленная форма.
Знак электродного потенциала совпадает со знаком электрода в гальваническом элементе, составленном из данного электрода и водородного. Все нормальные стандартные потенциалы сведены в таблицы или ряды.
ПРИМЕР. Гальванический элмент (-) Zn½ZnSO4½½H2SO4½Pt(H2) (+),
Условия стандартные, ЭДС = 0,764 вольта, Е0 (Zn2+/Zn) = -0,764 вольта.
Вместо водородного электрода можно использовать другие эталонные электроды, потенциалы которых в свою очередь известны относительно водородного электрода (хлоридсеребряный, каломельный и др.).
Следует иметь в виду, что, как правило, эти потенциалы не измеряют, а вычисляют из термодинамических данных.
Непосредственное измерение потенциалов затруднено из-за следующих факторов:
1. Металлы обычно содержат примеси.
2. Их поверхности покрыты пленками оксидов.
3. Равновесие устанавливается очень медленно.
4. Возможны побочные процессы (например, активные металлы растворяются в воде).
Ряд напряжений металлов (ряд активности).
Если расположить металлы в порядке возрастания их стандартных ОВ-потенциалов Е0(Меn+/Me0), то получим ряд напряжений металлов. В этот ряд помещают также водород, который, как и металлы, отдает электрон, образуя положительно заряженный ион.
Men+K+Ca2 + Al3 + Zn2 + Fe2 + Pb2 + 2H + Cu2 + Ag + Au 3+
Me0 K... Ca... Al... Zn... Fe... Pb... H2... Cu... Ag... Au
E0, вольт -2.92 -2.87 -1.66 -0.76 -0.44 -0.13 0 +0.34 +0.8 +1.5
1) каждый металл вытесняет из солей другие металлы, находящиеся в ряду напряжений правее него;
2) все металлы, стоящие в ряду левее водорода, вытесняют его из кислот-неокислителях, а стоящие правее – не растворяются в указанных кислотах;
3) чем левее в ряду напряжений находится металл, тем он активнее, тем более сильным восстановителем он выступает и тем труднее восстанавливаются его ионы.
Зависимость потенциала от концентрации ионов в растворе. Уравнение Нернста
 |
R = 8,315 Дж/(К×моль) –молярная газовая постоянная, F = 96500 Кл - константа Фарадея, Т- абсолютная температура, n – число электронов, участвующих в процессе, [Ox] и [Red] – молярные концентрации окисленной и восстановленной форм, моль/л (x и у – коэффициенты в уравнении реакции). Активная концентрация вещества в конденсированном состоянии принимается равной 1.
При 25°С (298 К) уравнение Нернста принимает вид:
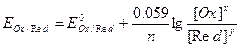 |
ПРИМЕРЫ.
1. Cu2+ + 2e = Cu 2. Fe3+ + e = Fe2+
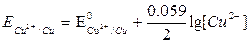 |  | ||
3. MnO4- + 8H+ +5e = Mn2+ + 4H2O
 |
4. Рассчитать значения потенциала Е (2Н+/Н2) в кислом (рН=0), нейтральном
(рН=7) и щелочном (рН = 14) растворах (Рн2 = 1 атм).
2Н+ + 2е = Н2, Е0 = 0
Е(2Н+/Н2) = Е0 + (0.059/2)lg[H+]2 = 0.059 lg[H+]= -0.059pH
| pH | |||
| E(2Н+/Н2) | -0.41 | -0.83 |
Гальванический элемент (ГЭ)
Устройство, в котором энергия химической реакции преобразуется в электрическую энергию. Состоит из двух электродных систем (двух полуэлементов).
Рис.26. Схема ГЭ Даниэля-Якоби
Электроды соединены проводником (внешняя цепь – лампочка, звонок). Внутренняя цепь замыкается за счет перемещения ионов через пористую перегородку или с помощью электролитического ключа.
На электродах ГЭ протекают процессы:
(-) Zn - 2e = Zn2+ - О тдача электронов, О кисление, А нод
(+) Cu2+ + 2e = Cu - прием электронов, восстановление, катод
Zn + Cu2+ = Zn2++ Cu - cуммарная ОВ-реакция, энергия которой превращается в электрический ток.
Постоянное протекание процессов на электродах способствует сохранению постоянной разности потенциалов, а следовательно, постоянному переходу электронов с Zn на Cu (электрический ток).
Условная запись ГЭ: (-) Zn½ZnSO4½½CuSO4½Cu (+)
Знак ½½ – условное обозначение контакта электролитов через пористую перегородку или электролитический ключ.
Е0 (Zn2+/Zn) = -0,764 B E0 (Cu2+/Cu) = +0,34 B
Отрицательным полюсом ГЭ (-) является электродная система с меньшим значением потенциала.
Разность ОВ потенциалов, храктеризующих катодный и анодный процессы, определяет электродвижущую силу гальванического элемента (ЭДС). ЭДС всегда положительная величина.
ЭДС = Е(+) – Е(-) = 0,34 – (-0,76) = 1,1 В.
По мере работы элемента уменьшается напряжение и ток. Это связано с изменением потенциалов за счет концентрационной поляризации электродов. В приэлектродном пространстве вследствие разряда ионов происходит изменение их концентраций. Около цинкового электрода концентрация ионов металла растет вследствие его растворения, а около медного - падает, что и приводит к изменению потенциалов, а значит и ЭДС.
Особенности измерения ЭДС.
1. Необходимо обеспечить отсутствие тока в цепи, чтобы исключить концентрационную поляризацию электродов (можно использовать компенсационный метод или использовать высокоомный вольтметр).
2. Необходимо свести к минимуму искажение ЭДС за счет диффузионного потенциала, который возникает на границе контакта двух электролитов, различных по составу и концентрации. За счет различной скорости диффузии ионов на границе между различными электролитами возникает двойной электрический слой и скачок потенциала Едиф.
Тогда, ЭДСизмер. = Е(+) - Е(-) + Едиф. Чтобы свести к нулу диффузионный потенциал, контакт между электролитами организуют с помощью электролитического ключа – соединительного сосуда, заполненного концентрированным раствором КС1. Благодаря большой концентрации ионы К+ и С1- диффундируют в оба электролита, а поскольку подвижность этих ионов одинаковая, то двойной электрический слой не образуется и Едиф.®0.
Топливные элементы.
Это гальванические элементы, в которых реакция горения непосредственно превращается в электрический ток: топливо - Н2, СО, природные и искусственные горючие газы и др.; oкислитель – кислород или воздух (реже фтор и хлор).
В топливных элементах, как и в обычных ГЭ, анод, к которому подается восстановитель (топливо) и катод, к которому подается окислитель, разделены ионопроводящим электролитом (кислотами и щелочами, расплавленными солями, твердыми оксидами).
Электроды в случае применения газообразных продуктов делают обычно из полых пористых графитовых трубок и пластин. На электроды наносят катализаторы – платиновые металлы, серебро, никель, кобальт и др. Токообразующий процесс совершается на границе соприкосновения электрода с электролитом.
ПРИМЕР. Водородно-кислородный топливный элемент. Топливо - Н2, окислитель - О2, электролит –
раствор щелочи: Анод: 2H2 + 4OH- - 4e = 4H2O
Катод: О2 + 2Н2О + 4е = 4ОН-
Суммарная реакция: 2Н2 + О2 = 2Н2О, энергия которой в данном случае не выделяется в виде тепла, а непосредственно превращается в электрическую.
Высокий коэффициент использования топлива, непрерывность действия, большой температурный диапазон позволяют уже сейчас использовать топливные элементы в спутниках и космических кораблях, а также для военных целей.
Электролиз
Электролиз – совокупность химических процессов, проходящих при протекании постоянного тока через расплав или раствор электролита. При этом энергия электрического тока превращается в энергию химической реакции.
Рис.27. Электролитическая ячейка
Установка для электролиза называется электролизером или электролитической ячейкой (ванной).
Внешний источник постоянного тока выполняет роль своеобразного насоса: «нагнетает» электроны на электрод, подключенный к (-) полюсу, и «откачивает» электроны с электрода, подключенного к (+).
На электроде (-) будут разряжаться ионы, способные забирать электроны (восстанавливаться) – это катод.
На электроде (+) разряжаются ионы, способные отдавать электроны (окисляться) – это анод.
Электролиз расплавов.
ПРИМЕР. (-) С ½расплав MgCl2½ C (+) MgCl2 ¾¾¾® Mg2+ + 2Cl-
Знак (-) означает, что этот электрод подключен к отрицательному полюсу источника постоянного тока, т.е. на этот электрод электроны “нагнетаются”. Ионы, способные принимать электроны будут восстанавливаться на этом электроде.
Электродные процессы:
(-) Mg2+ + 2e = Mg прием электронов, восстановление, катод;
(+) 2С1- - 2е = С12 о тдача электронов, о кисление, а нод.
Обратите внимение, что знаки полюсов катода и анода не совпадают со знаками в ГЭ. Но в любом случае на катоде всегда идут процессы восстановления, а на аноде – окисления.
| Название электрода | Знак электрода | Процесс | |
| ГЭ | Электролиз | ||
| Катод | + | - | Восстановление (+ ne) |
| Анод | - | + | Окисление (- ne) |
Электролиз воды.
Молекулы воды диссоциируют на ионы Н+ и ОН-, которые могут участвовать в электродных процессах.
На катоде (-) восстанавливаются ионы водорода (потенциалы см. в справочнике)
| 2Н+ + 2е = Н2 | рН = 0 | Е0 = 0 вольт |
| 2Н2О + 2е = Н2 + 2ОН- | рН = 7 рН = 14 | Е = -0.41 Е0 = -0.83 |
На аноде (+) окисляются ионы кислорода (потенциалы см. в справочнике)
| 2Н2О – 4е = О2 + 4Н+ | рН = 0 рН = 7 | Е0 = +1.23 Е = +0.815 |
| 4ОН- - 4е = О2 + 2Н2О | рН = 14 | Е0 = +0.401 |
Разность потенциала, которую надо приложить к электродам, чтобы началось разложение воды, называется потенциалом разложения. При любом значении рН Еразл. теор.(Н2О) @ 1,23 вольт.
Например, рН = 7, Еразл. = Е(+) – Е(-) = +0,815 – (-0,41) @ 1,23 вольт.
Еразл. реальный > Еразл. теор. Причина – перенапряжение электродов.
Перенапряжение электродов.
Для того, чтобы процессы протекали с заметной скоростью, необходимо приложить такой потенциал, который обеспечит определенную плотность тока на катоде (jк ) и аноде (jа ). Чем больше плотность тока, тем больше скорость реакции (до определенного предела). Графическая зависимость Е (j) – называется поляризационной кривой (это экспериментальная зависимость). Из рис.28 видно, что процесс разложения воды на
Pt-электродах при рН=7 будет протекать с заметной скоростью, если потенциал катода сместить в более отрицательную область по отношению к теоретическому (-0,41 вольт), а потенциал анода – в более положительную область по отношению к теоретическому значению (+0,815 вольт). Смещение реального потенциала разряда ионов на данном электроде от теоретического значения называется перенапряжением электрода.
Рис.28. Катодная и анодная поляризационные кривые процесса разложения воды
на Pt-электродах при рН=7 и на угольных электродах при рН=7
Перенапряжение электрода зависит от многих факторов (состава электролита, концентрации ионов, плотности тока), но особенно от типа электрода.
На Pt-электродах перенапряжение водорода и кислорода мало, поэтому можно пользоваться табличными значениями потенциалов с учетом среды.
На всех других электродах (угольных, металлических) – перенапряжение водорода и кислорода велико и его необходимо учитывать. Потенциал водорода смещается вплоть до значения (-0.8)¸(-1.0) вольт (в любой среде), а потенциал кислорода – вплоть до значения (+1.8) вольт (в любой среде).
Электролиз водных растворов солей.
Соли диссоциируют в растворе нацело на катионы и анионы (кислотные остатки), которые могут участвовать в конкурирующих процессах на катоде и аноде.
Катодные процессы – процессы восстановления, протекают на электроде (-). Из водных растворов солей восстанавливаться могут:
а) катионы металлов, Men+ + ne = Me0¯ - катодный осадок металла;
б) ионы водорода., 2Н+ + 2е = Н2 (при рН < 7)
2Н2О + 2е = Н2 + 2ОН- (при рН ³ 7)
Date: 2015-09-24; view: 482; Нарушение авторских прав