
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Химические свойства. I. Кислотно-оснóвные
|
|
I. Кислотно-оснóвные
АК за счет –I группы –NH2 являются более сильными к-тами, чем соответствующие им карбоновые к-ты и более слабыми основаниями, чем амины.
a-АК являются амфотерными соединениями, т.к. содержат в одной молекуле –NH2 гр., обусловливающую оснóвные св-ва и –СOOH – кислотные. Поэтому в зависимости от среды АК могут существовать в р-ре в виде катионов или анионов. В кислой среде протонируется –NH2 гр., в щелочной – –COOH гр. превращается в анион –СОО- . В среде близкой к нейтральной АК существует в виде диполярного иона:
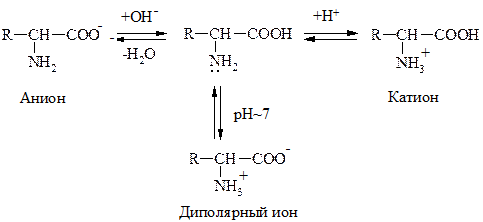
Значение рН р-ра, при котором АК имеет равное количество положительных и отрицательных зарядов, наз-ся изоэлектрической точкой (ИЭТ). Заряд белковой молекулы определяется суммой ионогенных групп –NH3+ и –COO–.
Изображение АК в неионизированной форме является упрощенным.
АК, как амфотерные соединения, образуют соли как с к-тами, так и с основаниями:
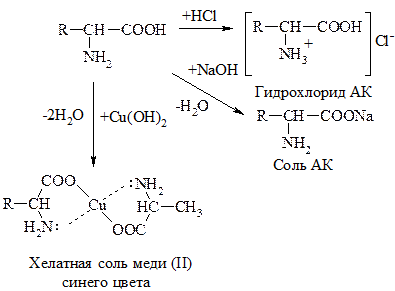
II. Р-ции по –СООН группе
АК могут диссоциировать, образовывать соли, сложные эфиры, ангидриды, амиды, хлорангидриды.

Эта р-ция используется как “защитная” в синтезе белков и пептидов.
III. Р-ции по –NH2 группе
а) Р-ция солеобразования (см.выше)
б) Р-ция с HNO2
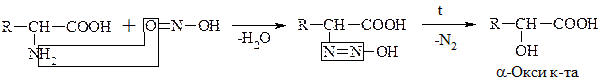
Эта р-ция дезаминирования in vitro. По количеству выделившегося азота определяют кол-во АК (метод Ван-Слайка).
в) Хлорангидриды и ангидриды к-т образуют с АК ацилпроизводные (подобно аминам и мочевине):
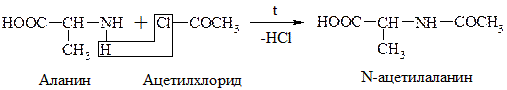
Эта р-ция используется для “защиты” –NH2 гр. в синтезе белков и пептидов.
г) Р-ция с формальдегидом
При взаимодействии с альдегидами a-АК, подобно первичным аминам, образуют основания Шиффа. Для аналитических целей применяется р-ция a-АК с формальдегидом, останавливающаяся на стадии N-гидроксиметильного производного АК (гидроксиметильной наз-ся гр. –СН2ОН):

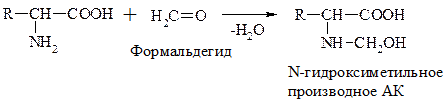
Последняя р-ция лежит в основе метода формольного титрования. Сами АК вследствие амфотерности не могут быть оттированы щелочью.
N-гидросиметильные производные АК содержат свободную –СООН гр. и могут быть определены количественно титрованием щелочью.
IV. Отношение АК к нагреванию
а) a-АК при нагревании могут отщеплять одну или две молекулы воды. При отщеплении одной молекулы воды образуются дипептиды:
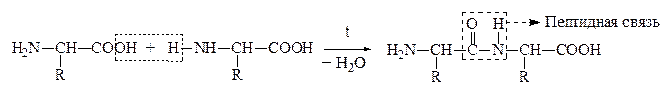
Дипептид обладает способностью взаимодействовать с новой молекулой АК с образованием трипептида, тетрапептида и полипептида. Последний является основой белковых молекул. Название ди– и полипептидов строится по названиям тех к-т, из которых они образуются. Поэтому АК, участвующая в образовании пептида имеет окончание –ИЛ, а концевая АК, сохранившая гр. –СООН – полное название:
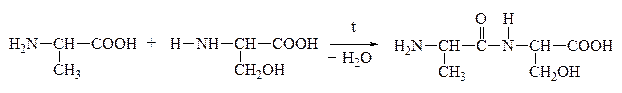
Аланин Серин АланИЛсерин
Используется сокращенная запись полипептида с указанием концевых групп и названий АК первыми тремя буквами русского или латинского алфавита:
Н2N – Ала – Тир – Гли – Глу – СООН
Аla Tyr Gly Glu
При отщеплении двух молекул воды от двух молекул АК образуется дикетопиперазин (циклический амид):

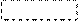
 +
+ 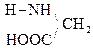
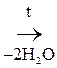
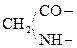
Глицин Дикетопиперазин
б) b-АК выделяют при нагревании NH3 и образуют непредельную к-ту, т.е. идет р-ция дезаминирования:
|
|
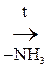
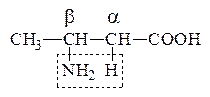
СН3–СН=СН–СООН
b-Аминомасляная к-та
в) g-АК образуют лактамы:
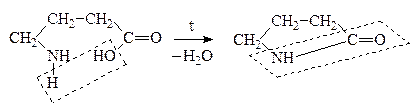 |
Лактамная
(пептидная) группа
|
g-Аминомасляная к-та
V. Р-ции дезаминирования:
В организме человека и животных под действием различных ферментов происходят процессы дезаминирования. Во всех случаях гр. -NH2 освобождается в виде NH3, а продуктами дезаминирования могут быть жирные к-ты, окси- и кеток-ты. При этом окислительное дезаминирование преобладает:
а) Окислительное дезаминирование
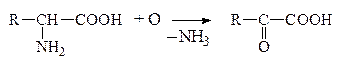
Оксок-та
б) Восстановительное
|
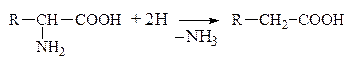
в) Гидролитическое
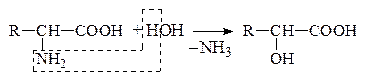
Оксик-та
г) Внутримолекулярное
|

VI. Р-ции декарбоксилирования
Карбоновые к-ты in vitro декарбоксилируются в очень жестких условиях. Введение в a-положение ЭА групп -NH2, 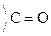 , –ОН способствует стабилизации карбоаниона и поэтому такие замещеные к-ты очень легко декарбоксилируются:
, –ОН способствует стабилизации карбоаниона и поэтому такие замещеные к-ты очень легко декарбоксилируются:
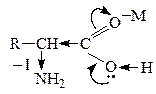
В лабораторных условиях АК легко декарбоксилируются в щелочной среде. В организме a-АК декарбоксилируются под действием фермента декарбоксилазы:
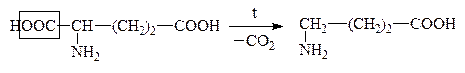
Глутаминовая к-та g-Аминомасляная к-та, ГАМК
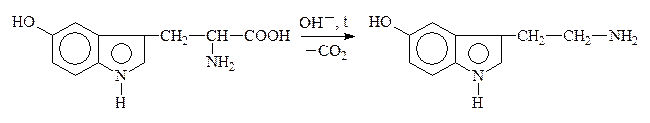
5-Окситриптофан 5-Окситриптамин,
серотонин
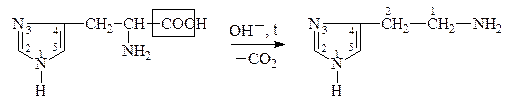
Гистидин, Гистамин,
a-амино-b-[4(5)-имидазолил]- 2-имидозолиламиноэтан,
пропионовая к-та 4(5)-аминоэтилимидазол
Образующиеся амины имеют большое физиологическое значение и наз-ся биогенными аминами. Они участвуют в ряде р-ций обмена нервной и сердечно-сосудистой систем. Нарушение обмена биогенных аминов влечет за собой возникновение патологических состояний, в частности, некоторых психозов, аллергических заболеваний, воспалительной и болевой реакций. Так, гистамин является сосудорасширяющим соединением, понижает кровяное давление. ГАМК играет большую роль в жизнедеятельности нервной системы, где не только обезвреживает NH3, но и влияет на дыхание, проведение нервных импульсов.
К биогенным аминам, образующимся из тирозина в процессе обмена веществ, относится группа катехоламинов: адреналин, норадреналин и дофамин:
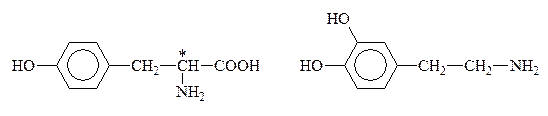
Тирозин Дофамин
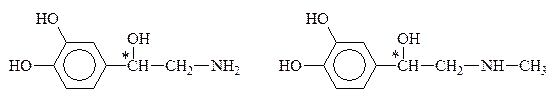
Норадреналин Адреналин
Дофамин, норадреналин и адреналин выполняют роль нейромедиаторов. Адреналин (5мг) является гормоном мозгового вещества надпочечников, а норадреналин и дофамин – его предшественниками. Адреналин участвует в регуляции сердечной деятельности, обмена углеводов. При физиологических стрессах он выделяется в кровь (“гормон страха”). Активность адреналина связана с конфигурацией хирального центра, определяющей взаимодествие с рецептором. Подобно 1,2-дигидроксибензолу, катехоламины с р-ром FeC13 дают изумрудно-зеленое окрашивание, переходящее в вишнево-красное при добавлении р-ра аммиака, что может служить качественной р-цией на эти соединения.
Из тирозина синтезируются также пигменты кожи, глаз, волос.
Кроме р-ций декарбоксилирования в организме протекают под влиянием ферментов много строго специфических р-ций: переаминирования, трансаминирования и др.
VII. Р-ции по радикалу
Все циклические АК, содержищие бензольное кольцо – триптофан, тирозин, фенилаланин – легко вступают в р-ции замещения по бензольному кольцу с На12, НО–NO2, HO–SO3H.
Путем йодирования тирозина в организме образуется гормон щитовидной железы тироксин:
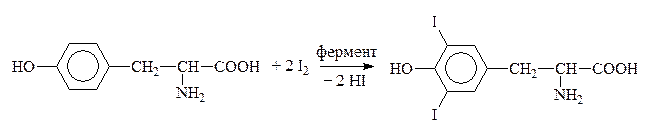
Тирозин Дийодтирозин
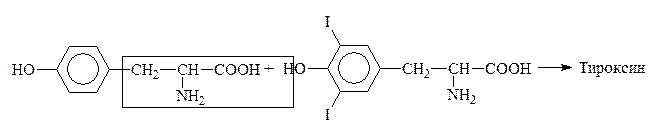
Качественная р-ция на ароматические АК – ксантопротеиновая – обусловлена нитрованием бензольного кольца с образованием нитросоединений желтого цвета. При добавлении к ним щелочи возникает оранжевое окрашивание:

VIII. Качественная р-ция на a-АК
Это р-ция с нингидрином:
a-AK
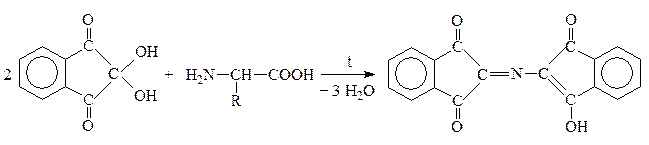 Нингидрин Продукт р-ции сине-фиолетового цвета
Нингидрин Продукт р-ции сине-фиолетового цвета
+ CO2 + R–CHO
Альдегид
IX. Р-ция на присутствие серусодержащих АК
|
|
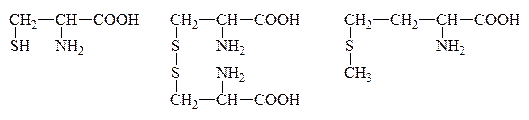
Цистин
Цистеин и цистин легко превращаются друг в друга за счет р-ции окисления-восстановления:
Цистеин 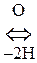 Цистин + Н2О
Цистин + Н2О
Обмен серы в организме идет, в основном, за счет цистина и цистеина. Они обусловливают структуру белка, реактивность многих ферментов и гормонов. За счет ферментативного окисления серы образуется H2SO4, которая вступает во взаимодействие с ядовитыми веществами, обезвреживая их.
Качественной р-цией на серусодержащие АК является р-ция Фоля:

Date: 2015-09-24; view: 614; Нарушение авторских прав