
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Схема 4
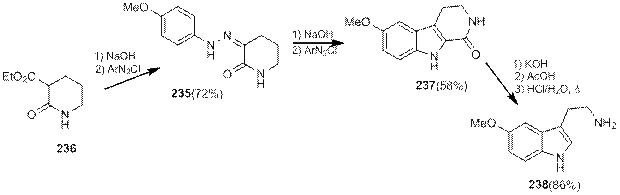
К третьей группе относится множество модификаций синтеза индолов по Фишеру, в которых в реакцию с фенилгидразоном вступают карбонильные соединения, не содержащие аминогруппу. Продуктом этих реакций являются индолы с этиленовым фрагментом, которые вдальнейшем могут быть превращены в триптамины.
В литературе можно найти примеры реакций, где в качестве предшественника аминоэтильной группы использовалась хлорэтильная группа. Так, при проведении реакции нитрофенилгидразина 222 с хлорбутаналем 223 выход 2-хлорэтильного производного 224 — предшественника триптамина 225 — оказался низким, что было обусловлено высокой реакционной способностью хлорида и низкой реакционной способностью нитрофенилгидразонов в условиях реакции Фишера [75].
Схема 5.
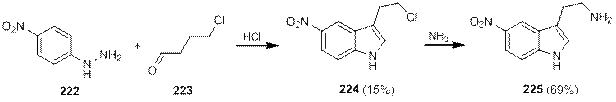
Тем не менее Грандберг и Боброва показали, что при использовании в описанной реакции алкиларилгидразинов 226, алкилирование незамещенного атома азота «галогенидным хвостом» с образованием N -(ариламино)пирролина происходит раньше перегруппировки Фишера, в результате чего образование триптамина 227 происходит в одну реакционную стадию, причем во многих случаях с очень высокими выходами (схема 1.75).
Схема 6.
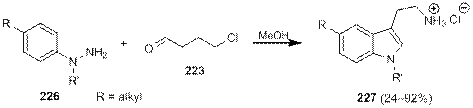
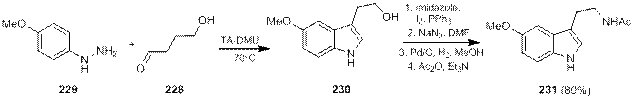
Приемлемый метод синтеза триптаминов по Фишеру через предшественники аминогруппы был разработан недавно Баскараном и Кенигом [77], которые синтезировали индольный цикл путем взаимодействия гидроксибутаналя 228 с п -метоксифенилгидразином 229 в расплаве эвтектической смеси винной кислоты с диметилмочевиной. Полученный гидроксиэтилиндол 230 далее был превращен в 5 стадий в мелатонин 231 с суммарным выходом 80% (схема 1.76).
Схема 7.
Во всех методах синтеза третьей группы представляется возможным введение заместителя как в альфа так и в бета положения боковой цепи, так как производные гидроксибутанля доступны, но в литературе не было найдено примеров проведения данных реакций.
К четвертой группе можно отнести реакции, в которых с фенилгидразонами реагируют вещества, не содержащие ни карбонильной, ни аминогруппы. Так, N -замещенные фенилгидразины 239 реагируют с 1-хлор-4-пентином (240) с образованием гидразонов, которые далее превращаются в триптамины 241 по механизму Грандберга. Введение заместителей в этиленовый фрагмент триптамина данной реакцией не представляется возможным, по причине неустойчивости замещенных хлорпентинов.
Схема 8.

Многие из этих методов, а также некоторые другие, аналогичные им, подробно описаны в обзоре Бидыло и Юровской, посвященном синтезу триптаминов по методу Фишера
Существует ряд методов, в которых так же, как и в синтезе по Фишеру, образование пиррольного цикла и аминоэтильного фрагмента происходит одновременно. Флеминг и др. [83] разработали метод синтеза триптаминов 245 из диаминоспиртов 246 под действием аммиака в метаноле (схема 1.81). При этом диаминоспирты синтезировали из аминокетонов 247, которые легко получались присоединением диалкиламинов к арилвинилкетону 248 по Михаэлю.
Схема 9.

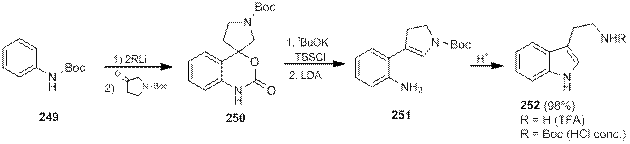
Стратегия синтеза триптаминов, предложенная Николау [84], заключается в последовательном превращении защищенных Boc-анилинов 249 в спирогетероциклы 250, а затем в о -замещенные анилины 251, циклизация которых в условиях кислотного катализа приводит к образованию триптаминов 252, причем при использовнии трифторуксусной кислоты происходит снятие защитной группы, в то время как при использовании концентрированной соляной кислоты снятия Boc-группы не происходит.
Схема 10.
Но вводить заместитель в боковую цепь триптамина с помощью методов одновременного построения индольного и этиленового фрагмента не по реакции Фишера невозможно, так как эти синтезы накладывают большие ограничения на исходные соединения.
Все вышеописанные методы объединяет то, что в них формирование индольного и этиленового фрагментов происходит одновременно, однако есть и другой подход к синтезу триптаминов, который заключается в формировании этиленового фрагмента путем модификации индола и его производных. Существует, например, метод прямого аминоэтилирования индолилмагний иодида 256 хлораминами 257 [86], однако выход триптаминов 258 в этом случае оказывается крайне низким (схема 1.84).
Схема 11.
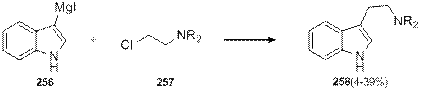
При действии оксалилхлорида на индол (273) с высоким выходом образуется индолглиоксилхлорид (274), который далее превращается в амид 275, восстановление которого дает триптамин. По понятным причинам (Так как источником этиленового фрагмента в данной реакции является оксалилхлорид) введение заместителей в боковую цепь невозможно.
Схема 12.

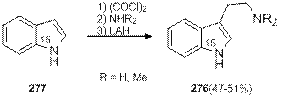
В последствии этот метод был использован для синтеза триптаминов 276 из индола 277, содержащих изотопную метку 15N в индоле (схема 1.90). Данные соединения были интересны с точки зрения изучения продуктов их метаболизма в живых организмах [93].
Схема 13.
Синтез триптаминов с участием галогенной функции возможен и путем ацилирования индола α-галогенкарбонилхлоридами. Действие азида натрия на галогенацилиндолы 270 приводит к образованию азидов 271, которые далее превращаются в триптамины 272 восстановлением алюмогидридом лития [91]. Данная реакция является хорошим методом введения Заместителя в альфа положение боковой цепи триптамина.
Схема 14.

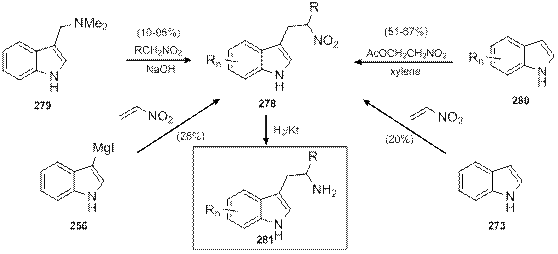
Предшественниками триптаминов могут быть также соответствующие нитропроизводные. Например, 3-(2-нитроэтил)индолы 278 образуются при взаимодействии грамина 279 с нитроалканами в присутствии щелочи, причем данный метод позволяет вводить заместитель в этиленовый фрагмент триптамина [94]. Аналогичные нитропроизводные 278 образуются и при алкилировании индола 280 ацетоксинитроэтаном [95]. Также [96], при взаимодействии индола 273 или индолилмагнийиодида 256 с нитроэтиленом получается (нитроэтил)индол 278 (в обоих случаях с невысокими выходами). При этом в случае алкилирования индола ацетатом нитрогруппа яляется защищенной формой аминогруппы, в то время как в остальных случаях акцепторные свойства нитрогруппы являются принципиальными для возможности протекания реакции. Во всех случаях каталитическое гидрирование приводило к образованию производных триптамина 281 (схема 1.91).
Схема 15.
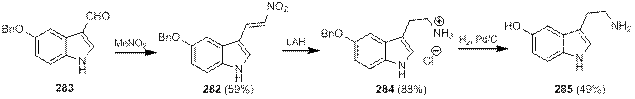
При синтезе серотонина (и его близких аналогов) Юнг использовал (2-нитровинил)индол 282, который легко получается по реакции формилиндола 283 с нитрометаном (схема 1.92). Восстановление его с помощью LiAlH4 привело к образованию триптамина 284, а дальнейшее каталитическое гидрирование и последующая обработка креатинин-сульфатом дали серотонин 285 в виде креатинин-сульфатного комплекса[97].
Схема 16.
Date: 2015-09-24; view: 490; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |